题目内容
在含有Cu(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入铁粉,经充分反应后铁粉完全溶解,过滤、洗涤、干燥得固体产物12.4g,则溶解的铁粉的质量是( )
| A、5.6 g |
| B、7 g |
| C、2.8 g |
| D、8.4 g |
考点:化学方程式的有关计算
专题:计算题
分析:氧化性是Ag+>Fe3+>Cu2+,0.1molAg+完全反应得到Ag为0.1mol×108g/mol=10.8g,小于12.4g,故生成Cu的质量为12.4g-10.8g=1.6g,其物质的量为
=0.025mol<0.1mol,故Cu2+有剩余,溶液中Fe3+完全反应,根据电子转移守恒计算参加反应Fe的物质的量,再根据m=nM计算其质量.
| 1.6g |
| 64g/mol |
解答:
解:氧化性是Ag+>Fe3+>Cu2+,0.1molAg+完全反应得到Ag为0.1mol×108g/mol=10.8g,小于12.4g,故生成Cu的质量为12.4g-10.8g=1.6g,其物质的量为
=0.025mol<0.1mol,故Cu2+有剩余,溶液中Fe3+完全反应,根据电子转移守恒,参加反应Fe的物质的量为
=0.125mol,故参加反应Fe的质量为0.125mol×56g/mol=7g,
故选B.
| 1.6g |
| 64g/mol |
| 0.1mol×1+0.1mol×1+0.025mol×2 |
| 2 |
故选B.
点评:本题考查混合物计算,注意根据离子氧化性判断反应先后顺序,根据固体质量判断反应程度,结合电子转移守恒计算,侧重考查学生分析计算能力,难度中等.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
 如图是两组物质之间在一定的条件下相互转化的过程.下列绿色植物通过光合作用说法不正确的是( )
如图是两组物质之间在一定的条件下相互转化的过程.下列绿色植物通过光合作用说法不正确的是( )| A、物质X是O2 |
| B、绿色植物通过光合作用,将太阳能转化成化学能 |
| C、C6H12O6是碳氢氧三种元素组成的化合物 |
| D、C6H12O6与X反应生成CO2和H2O属于置换反应 |
 已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )
已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )| A、前10min内,用v(A)为0.02mol/(L?min) |
| B、反应进行前10min时,体系吸收热量9.76kJ |
| C、b、c、d三点中反应速率d>b=c |
| D、25min时,导致平衡移动的原因是升温 |
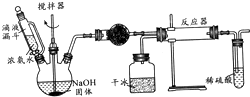 实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.

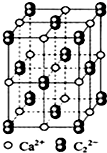 CaC2可用于固氮:CaC2+N2
CaC2可用于固氮:CaC2+N2