题目内容
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、pH相等的下列溶液①(NH4)2SO4、②NH4HSO4、③NH4Cl,c(NH4+)的大小关系为①=③>② |
| B、0.1mol/L的NaHA溶液,若pH=4,则溶液中存在:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| C、在NaHCO3和Na2CO3的混合溶液中一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D、在物质的量浓度之比为1:2的NaClO、NaHCO3的混合溶液中一定存在:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
考点:离子浓度大小的比较
专题:离子反应专题
分析:A、从两个角度考虑,一是相同pH的(NH4)2SO4与NH4Cl溶液的水解程度是否相等,二是NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,以此来解答;
B、0.1mol/L的NaHA溶液,若pH=4,溶液显示酸性,HA-的电离程度大于水解程度进行判断;
C、根据电荷守恒,可知c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-);
D、氯元素的所有存在形式的浓度之和与碳元素的所有存在形式之和之比为1:2,所以2c(HClO)+2c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-).
B、0.1mol/L的NaHA溶液,若pH=4,溶液显示酸性,HA-的电离程度大于水解程度进行判断;
C、根据电荷守恒,可知c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-);
D、氯元素的所有存在形式的浓度之和与碳元素的所有存在形式之和之比为1:2,所以2c(HClO)+2c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-).
解答:
解:A、相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,故答案应为①=③>②,故A正确;
B、在NaHA溶液中,HA-的电离程度大于水解程度,溶液显示酸性,所以离子大小关系是:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH- )>c(H2A),故B错误;
C、根据电荷守恒,可知c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D、氯元素的所有存在形式的浓度之和与碳元素的所有存在形式之和之比为1:2,所以2c(HClO)+2c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故D错误;
故选A.
B、在NaHA溶液中,HA-的电离程度大于水解程度,溶液显示酸性,所以离子大小关系是:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH- )>c(H2A),故B错误;
C、根据电荷守恒,可知c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D、氯元素的所有存在形式的浓度之和与碳元素的所有存在形式之和之比为1:2,所以2c(HClO)+2c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故D错误;
故选A.
点评:本题考查较为综合,涉及弱电解质的电离、电荷守恒、盐类的水解以及混合溶液的物料守恒,题目难度中等.

练习册系列答案
相关题目
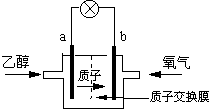 一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )
一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )| A、a极为电池的正极 |
| B、电池工作时电流由a极沿导线经灯泡再到b极 |
| C、电池负极的电极反应为:4H++O2+4e-=2H2O |
| D、电池工作时,1mol乙醇被氧化时就有12mol电子转移 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol苯分子含有3NA个C-C键 |
| B、一定条件下,1mol N2和3mol H2充分混合,反应后转移的电子数为6NA |
| C、常温下,78.0g Na2O2与58.5g NaCl所含阴离子数相等 |
| D、标准状况下,2.24L CCl4所含分子数为0.1 NA |
下列变化属于化学变化,且产物中兼有气体、液体、固体的是( )
| A、石油的分馏 | B、石油的裂解 |
| C、煤的干馏 | D、煤的气化 |
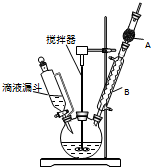 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示. CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.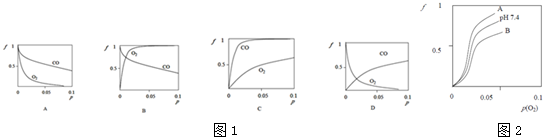
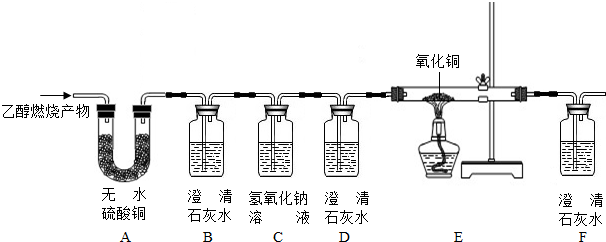
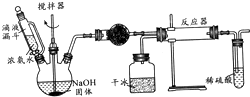 实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.