题目内容
下列说法正确的是( )
A、相同条件下,结合质子的能力:OH->AlO2->CO32->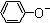 >HCO3->CH3COO- >HCO3->CH3COO- |
B、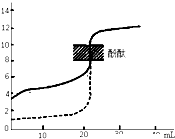 如图表示用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率,平衡常数保持不变 |
| D、恒容密闭容器中进行的反应A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
考点:酸碱混合时的定性判断及有关ph的计算,化学平衡的影响因素,弱电解质在水溶液中的电离平衡
专题:
分析:A、酸性越弱,酸越难电离,对应的酸根离子越易结合氢离子;
B、物质的量浓度和体积相同的盐酸和醋酸中,随着加入氢氧化钠的量的增加,醋酸会电离出一部分氢离子;
C、使用催化剂能加快反应速率,但平衡不移动,温度不变平衡常数保持不变;
D、在体积不变的情况下,充入一定量的A气体,相当于增大压强.
B、物质的量浓度和体积相同的盐酸和醋酸中,随着加入氢氧化钠的量的增加,醋酸会电离出一部分氢离子;
C、使用催化剂能加快反应速率,但平衡不移动,温度不变平衡常数保持不变;
D、在体积不变的情况下,充入一定量的A气体,相当于增大压强.
解答:
解:A、酸性越弱,酸越难电离,对应的酸根离子越易结合氢离子,酸性由强到弱顺序为:CH3COOH>H2CO3>苯酚>HCO3->Al(OH)3>H2O,所以结合质子的能力:OH->AlO2->CO32->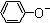 >HCO3->CH3COO-,故A正确;
>HCO3->CH3COO-,故A正确;
B、用0.1mol/LNaOH溶液滴定醋酸时,随着加入氢氧化钠的量的增加,醋酸会电离出一部分氢离子,所以出现的pH值突越要缓慢,即其中实线表示的是滴定醋酸的曲线,故B错误;
C、使用催化剂能加快反应速率,但平衡不移动,温度不变平衡常数保持不变,故C错误;
D、在体积不变的情况下,充入一定量的A气体,相当于增大压强,平衡逆向移动,A的转化率将减小,故D错误;
故选A.
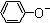 >HCO3->CH3COO-,故A正确;
>HCO3->CH3COO-,故A正确;B、用0.1mol/LNaOH溶液滴定醋酸时,随着加入氢氧化钠的量的增加,醋酸会电离出一部分氢离子,所以出现的pH值突越要缓慢,即其中实线表示的是滴定醋酸的曲线,故B错误;
C、使用催化剂能加快反应速率,但平衡不移动,温度不变平衡常数保持不变,故C错误;
D、在体积不变的情况下,充入一定量的A气体,相当于增大压强,平衡逆向移动,A的转化率将减小,故D错误;
故选A.
点评:本题是一道有关酸性的比较、滴定知识和平衡移动的综合题目,可以根据已有知识来解答,题目难度中等.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
下列有关有机化合物的叙述正确的是( )
| A、进入人体的重金属盐能使蛋白质变性,所以会使人中毒 |
| B、卤代烃C4H8Cl2有四种同分异构体 |
| C、甲烷是天然气的主要成分,能发生加成反应 |
| D、用驴皮熬制成的胶(阿胶)是一种天然橡胶,属于天然高分子化合物 |
下列说法正确的是( )
| A、4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5NA | ||||||||||
| B、一定温度下,氯化铵水解离子方程式:NH+4+H2O?NH3?H2O+H+,若用KW表示的离子积,Kb表示氨水电离常数,则氯化铵水解平衡常数K=KW/Kb | ||||||||||
| C、已知反应:2Fe3++2I-=2Fe2++I2:2Co(OH)3+2Cl-+6H+=2Co2++Cl2↑+6H2O:2Fe(OH)2+I2+2OH-=2Fe(OH)3+2I-;则在酸性溶液中氧化性:Fe3+>Co(OH)3>I2 | ||||||||||
D、已知
|
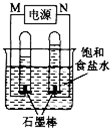 CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
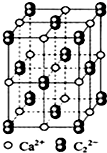 CaC2可用于固氮:CaC2+N2
CaC2可用于固氮:CaC2+N2