题目内容
19. A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.
A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.已知:①A原子核是一个质子;
②B的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;
③D的基态原子的核外成对电子数是未成对电子数的3倍;
④A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数比为1:1的化合物N的质荷比最大值为78;
⑤E原子有4个未成对电子
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)化合物M的中心原子采取sp2杂化,化合物N在固态时的晶体类型为分子晶体.
(2)由上述一种或多种元素组成的与BD2互为等电子体的分子为N2O(写分子式),写出BC-的电子式
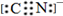 ,
,(3)写出基态E原子的核外价电子排布图

(4)E能与BD分子形成配位化合物E(BD)5,其中BD分子提供孤对电子1mol E (BD)5中含有10molσ键.
(5)化合物CD2中C原子的价层电子对互斥模型为平面三角形其在实验室中可被Na2CO3溶液吸收形成两种C的不同价态的含氧酸盐,其离子方程式为CO32-+2NO2═NO2-+NO3-+CO2
(6)E晶体的晶胞(如图),实验测得E的密度为ρ(g•cm-3). 已知E的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定E原子为等径的刚性球且处于体对角线上的三个球相切.则E原子的半径 r=$\frac{\sqrt{3}}{4}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$×1010pm.
分析 A、B、C、D、E为周期表中原子序数依次递增的前四周期元素,①A原子核是一个质子,则A为H,②B的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同,则B为C,③D的基态原子的核外成对电子数是未成对电子数的3倍,则D的电子排布式为1s22s22p4,所以D为O,则C为N,④A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,所以M为甲醛,A、B两种元素组成的原子个数比为1:1的化合物N的质荷比最大值为78,则N为C6H6,⑤E原子有4个未成对电子,则E为Fe,据此答题.
解答 解:A、B、C、D、E为周期表中原子序数依次递增的前四周期元素,①A原子核是一个质子,则A为H,②B的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同,则B为C,③D的基态原子的核外成对电子数是未成对电子数的3倍,则D的电子排布式为1s22s22p4,所以D为O,则C为N,④A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,所以M为甲醛,A、B两种元素组成的原子个数比为1:1的化合物N的质荷比最大值为78,则N为C6H6,⑤E原子有4个未成对电子,则E为Fe,
(1)M为甲醛,M的中心原子碳原子的价层电子对数为$\frac{4+2}{2}$=3,所以碳原子的杂化方式为sp2杂化,化合物N为C6H6,N在固态时的晶体类型为分子晶体,
故答案为:sp2;分子晶体;
(2)BD2为CO2,根据等电子体的概念可知,由上述一种或多种元素组成的与BD2互为等电子体的分子为 N2O,CN-的电子式 为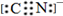 ,
,
故答案为:N2O;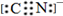 ;
;
(3)E为Fe,基态E原子的核外价电子排布图为 ,
,
故答案为: ;
;
(4)Fe能与CO分子形成配位化合物Fe(CO)5,其中CO分子作配体,提供孤对电子,每个CO中含有一个σ键,所以1mol Fe(CO)5中含有10molσ键,
故答案为:孤对电子;10;
(5)化合物NO2中N原子的价层电子对数为$\frac{5+1}{2}$=3,所以其互斥模型为平面三角形,NO2被Na2CO3溶液吸收生成硝酸盐和亚硝酸盐,其离子方程式为 CO32-+2NO2═NO2-+NO3-+CO2,
故答案为:平面三角形;CO32-+2NO2═NO2-+NO3-+CO2;
(6)根据铁晶体的晶胞图,可知,每个晶胞中含有铁原子数为$8×\frac{1}{8}+1$=2,所以晶胞的体积V为$\frac{m}{ρ}$=$\frac{\frac{2a}{{N}_{A}}}{ρ}$=$\frac{2a}{{N}_{A}ρ}$cm3,晶胞的边长为$\root{3}{\frac{2a}{{N}_{A}ρ}}$cm,假定铁原子为等径的刚性球且处于体对角线上的三个球相切,所以铁原子的半径为晶胞体对角线的$\frac{1}{4}$,则铁原子的半径 r=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2a}{{N}_{A}ρ}}$cm=$\frac{\sqrt{3}}{4}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$×1010pm,
故答案为:$\frac{\sqrt{3}}{4}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$×1010.
点评 本题是对物质结构的考查,涉及电负性、核外电子排布、微粒结构、杂化轨道、晶胞计算等,要学会用均摊法进行晶胞的计算,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 在实验过程中水的电离程度的变化趋势是先减小后增大 | |
| B. | 当滴加盐酸至溶液pH<7时,此时溶液中溶质一定是HCl和NH4Cl | |
| C. | 当滴加盐酸至溶液pH=7时,此时溶液中,c(NH4+)>c(Cl-) | |
| D. | 当滴加盐酸至恰好完全中和时,c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| A. | 0.10 mol•L-1的醋酸钠溶液20mL与0.10 mol•L-1盐酸10mL混合后溶液显酸性:c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH) | |
| B. | pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-)=c (H+)=c(OH-) | |
| C. | 若0.10 mol•L-1的醋酸的pH=a,0.010 mol•L-1的醋酸的pH=b,则a+1>b | |
| D. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
| A. | 2Al2O3(熔融) $\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | |
| B. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| C. | Fe+CuSO4═FeSO4+Cu | |
| D. | 2NaCl(水溶液)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ |
| A. | 酸性:HClO>H2CO3 | B. | 电负性:N>O>C | ||
| C. | 晶体熔点的高低: | D. | 稳定性:H2O<NH3<PH3<SiH4 |
| A. | SO2气体通入NaOH溶液中,产生倒吸现象,说明SO2极易溶于水 | |
| B. | 将SO2通入BaCl2 溶液中至饱和,无沉淀产生,再通入Cl2,产生白色沉淀 | |
| C. | SO2气体通入溴水中,溴水的颜色褪去,说明SO2具有漂白性 | |
| D. | SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成 |
| A. | FeCl2 | B. | Na2S | C. | Fe(OH)3 | D. | CuS |
| A. | 二氧化碳通入饱和碳酸钠溶液会有固体析出 | |
| B. | 用PH计测得某碱性溶液的pH为12.5 | |
| C. | 量取10.00ml水可以用滴定管或量筒 | |
| D. | 除去氯气中混有的氯化氢可通入饱和食盐水 |
| A. | 加入铝粉能产生氢气的溶液:NH4+、K+、HCO3-、Br- | |
| B. | 含有KSCN的溶液:Na+、Fe3+、SO32-、OH- | |
| C. | c(KNO3)为1.0mol•L-1的溶液:H+、Fe2+、Cl-、SO42- | |
| D. | pH=14的溶液:Na+、K+、NO3-、AlO2- |