题目内容
8.下列说法不正确的是( )| A. | 二氧化碳通入饱和碳酸钠溶液会有固体析出 | |
| B. | 用PH计测得某碱性溶液的pH为12.5 | |
| C. | 量取10.00ml水可以用滴定管或量筒 | |
| D. | 除去氯气中混有的氯化氢可通入饱和食盐水 |
分析 A.相同条件下,碳酸钠的溶解度大于碳酸氢钠;
B.pH计可测定pH,准确到0.1;
C.量筒的准确度为0.1mL;
D.HCl极易溶于水,食盐水可抑制氯气的溶解.
解答 解:A.相同条件下,碳酸钠的溶解度大于碳酸氢钠,则二氧化碳通入饱和碳酸钠溶液会有固体析出,故A正确;
B.pH计可测定pH,准确到0.1,则用pH计测得某碱性溶液的pH为12.5,故B正确;
C.量筒的准确度为0.1mL,量取10.00ml水可以用滴定管,故C错误;
D.HCl极易溶于水,食盐水可抑制氯气的溶解,则除去氯气中混有的氯化氢可通入饱和食盐水,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、仪器的使用为解答的关键,侧重分析与应用能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
18.电子工业中常用FeCl3溶液腐蚀印刷电路板,欲从腐蚀后的废液中回收Cu及制取纯净的FeC13溶液,需要下列试剂:①蒸馏水②铁粉 ③浓H2SO4 ④盐酸⑤烧碱 ⑥浓氨水 ⑦C12 中的( )
| A. | ②④⑦ | B. | ①③④ | C. | ②④⑥ | D. | ④⑥⑦ |
16.下列分离或提纯物质的说法正确的是( )
| A. | 过滤,可以除去NaCl溶液中少量的淀粉胶体 | |
| B. | 溶解、过滤,可以提纯含少量BaSO4的BaCO3 | |
| C. | 加热蒸发,可以除去粗盐中的CaCl2、MgCl2等杂质 | |
| D. | 加入足量铁屑,充分反应后,过滤,可以除去FeCl2溶液中少量FeCl3 |
3.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 9gD2O 中含有的电子数为 5NA | |
| B. | 92gNO2和 N2O4混合气体中含有原子数为 6NA | |
| C. | 1molC3H8分子中共价键总数为 8 NA | |
| D. | 65 g Zn 全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为 NA |
13.常温下,向 20mL 0.1mol•L-1 NH4HSO4溶液中滴加 0.1mol•L-1 Ba(OH)2 溶液,溶液 pH 与 Ba(OH)2溶液体积的关系曲线如图所示.已知NH3•H20的电离常数Kb(NH3•H20)=1.75×10-5.下列有关分析正确的是( )

| A. | a点时溶液的pH=7 | |
| B. | c点时的溶质是(NH3•H2O) | |
| C. | b点时溶液中c(NH4+)>c(NH3•H2O) | |
| D. | a~c段参与反应的离子有H+、OH-、Ba2+、SO42- |
20.下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ)
在一定条件下,1mol H2与1mol Cl2反应生成2mol HCl的能量变化为( )
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
| A. | 放出248 kJ 热量 | B. | 吸收248 kJ 热量 | C. | 放出183kJ热量 | D. | 吸收183 kJ热量 |
17.由气体发生装置导出的气体是甲烷、一氧化碳、氢气中的一种,下列推断正确的是( )
| A. | 将气体通入高锰酸钾酸性溶液和溴水,溶液颜色无变化,该气体一定是甲烷 | |
| B. | 在导管口点燃该气体,火焰呈淡蓝色,用内壁涂有澄清石灰水的烧杯罩在火焰上方,烧杯壁上有白色物质产生,该气体一定是甲烷 | |
| C. | 在导管口点燃该气体,火焰呈淡蓝色,用干燥的冷烧杯罩在火焰上方,烧杯壁上有水珠产生,该气体一定是甲烷 | |
| D. | 若上述B和C的现象均能出现,则可判断该气体一定是甲烷 |
18.下列各组物质的溶液,不加任何其他试剂,就能将其一一区别出来的是( )
| A. | NaCl、Na2CO3、Ba(NO3)2、H2SO4 | B. | BaCl2、CuSO4、NaOH、NaCl | ||
| C. | NaCl、NaOH、H2SO4、Ba(NO3)2 | D. | K2SO4、BaCl2、K2CO3、KNO3 |
 A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.
A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.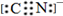 ,
,