题目内容
9.在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量.则下列叙述正确的是( )| A. | 在实验过程中水的电离程度的变化趋势是先减小后增大 | |
| B. | 当滴加盐酸至溶液pH<7时,此时溶液中溶质一定是HCl和NH4Cl | |
| C. | 当滴加盐酸至溶液pH=7时,此时溶液中,c(NH4+)>c(Cl-) | |
| D. | 当滴加盐酸至恰好完全中和时,c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
分析 A.酸或碱抑制水电离,含有弱根离子的盐促进水电离;
B.当恰好完全中和得到氯化铵溶液时,溶液也显酸性;
C.要根据溶液酸碱性结合电荷守恒判断;
D.当滴加盐酸恰好完全中和时,得到氯化铵溶液.
解答 解:A.酸或碱抑制水电离,氯化铵促进水电离,所以在实验过程中水的电离程度先变大后变小,故A错误;
B.当恰好完全中和得到氯化铵溶液时,溶液也显酸性,pH也小于7,故当溶液pH<7时,此时溶液中溶质不一定是HCl和NH4Cl,故B错误;
C.当滴加盐酸至溶液pH=7时,即有:c(H+)=c(OH-),根据电荷守恒可知:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则有:c(Cl-)=c(NH4+),故C错误;
D.当滴加盐酸恰好完全中和时,得到氯化铵溶液,溶液显酸性,故有:c(H+)>c(OH-),根据电荷守恒可知c(Cl-)>c(NH4+),则有:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故D正确.
故选D.
点评 本题考查酸碱混合溶液定性判断,根据溶液中的溶质结合电荷守恒来分析解答,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2; ②Fe2O3③Zn;④KNO3; ⑤HCl; 铜粉可溶解的是( )
| A. | ①②⑤ | B. | ②④ | C. | ②③⑤ | D. | 只有④ |
 探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质:
探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质:
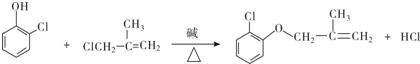 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).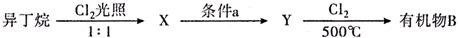
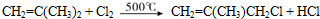 ;
;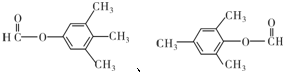
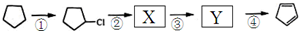

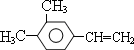 (任写一种).金刚烷与四氢二聚环戊二烯的关系是B.(填字母)
(任写一种).金刚烷与四氢二聚环戊二烯的关系是B.(填字母)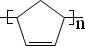 ..
.. .请写出下列反应的有机产物的结构简式:
.请写出下列反应的有机产物的结构简式: OHC-CHO、OHC-CH2-CHO.
OHC-CHO、OHC-CH2-CHO. A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.
A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.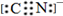 ,
,