题目内容
4.在探究SO2性质的实验中,下列说法正确的是( )| A. | SO2气体通入NaOH溶液中,产生倒吸现象,说明SO2极易溶于水 | |
| B. | 将SO2通入BaCl2 溶液中至饱和,无沉淀产生,再通入Cl2,产生白色沉淀 | |
| C. | SO2气体通入溴水中,溴水的颜色褪去,说明SO2具有漂白性 | |
| D. | SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成 |
分析 A.二氧化硫属于酸性氧化物,极易和NaOH反应;
B.通入Cl2,将亚硫酸氧化成硫酸,与氯化钡反应生成硫酸钡;
C.二氧化硫具有还原性,溴具有强氧化性,二者发生氧化还原反应;
D.二氧化硫和硝酸钡溶液发生氧化还原反应生成硫酸根离子,硫酸根离子和钡离子发生复分解反应.
解答 解:A.二氧化硫属于酸性氧化物,极易和NaOH反应生成亚硫酸钠,但二氧化硫不是极易溶于水的气体,故A错误;
B.通入Cl2,将亚硫酸氧化成硫酸,与氯化钡反应生成硫酸钡,所以产生白色沉淀硫酸钡,故B正确;
C.二氧化硫具有还原性,溴具有强氧化性,二者发生氧化还原反应生成硫酸和HBr,二氧化硫体现还原性,故C错误;
D.二氧化硫和硝酸钡溶液发生氧化还原反应生成硫酸根离子,硫酸根离子和钡离子发生复分解反应,所以最后得到的沉淀是BaSO4,故D错误;
故选B.
点评 本题考查二氧化硫性质,二氧化硫具有氧化性、还原性和漂白性,能被强氧化剂氧化而体现还原性,易错选项是D.

练习册系列答案
相关题目
15.在常温下,把氨水滴加到盐酸中,当c(NH+4)=c(Cl-)时,下列叙述中正确的是( )
| A. | 混合溶液的pH等于7 | B. | 混合溶液的pH大于7 | ||
| C. | 加入酸碱的物质的量相等 | D. | 混合溶液还能再中和盐酸 |
12.下列说法中正确的是( )
| A. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| B. | 金属Na、Mg、Al的硬度依次降低 | |
| C. | 由原子间通过共价键而形成的晶体一般具有高的熔、沸点及硬度 | |
| D. | PCl3和CO32-的中心原子的杂化方式相同,都是sp3杂化 |
9.在下列反应中,既是化合反应,又是氧化还原反应的是( )
| A. | 生石灰和水反应 | B. | 三氧化硫和水反应 | ||
| C. | 铁和氯气反应 | D. | 氨气和氯化氢反应 |
16.下列分离或提纯物质的说法正确的是( )
| A. | 过滤,可以除去NaCl溶液中少量的淀粉胶体 | |
| B. | 溶解、过滤,可以提纯含少量BaSO4的BaCO3 | |
| C. | 加热蒸发,可以除去粗盐中的CaCl2、MgCl2等杂质 | |
| D. | 加入足量铁屑,充分反应后,过滤,可以除去FeCl2溶液中少量FeCl3 |
13.常温下,向 20mL 0.1mol•L-1 NH4HSO4溶液中滴加 0.1mol•L-1 Ba(OH)2 溶液,溶液 pH 与 Ba(OH)2溶液体积的关系曲线如图所示.已知NH3•H20的电离常数Kb(NH3•H20)=1.75×10-5.下列有关分析正确的是( )

| A. | a点时溶液的pH=7 | |
| B. | c点时的溶质是(NH3•H2O) | |
| C. | b点时溶液中c(NH4+)>c(NH3•H2O) | |
| D. | a~c段参与反应的离子有H+、OH-、Ba2+、SO42- |
14.下列反应中,属于取代反应的是( )
| A. | 实验室制取乙烯 | |
| B. | 乙酸与乙醇在浓硫酸和加热条件下的酯化反应 | |
| C. | 葡萄糖与银氨溶液反应 | |
| D. | 乙醛和氢气的反应 |
 A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.
A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.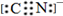 ,
,