题目内容
14.下列有关性质的比较中,正确的是( )| A. | 酸性:HClO>H2CO3 | B. | 电负性:N>O>C | ||
| C. | 晶体熔点的高低: | D. | 稳定性:H2O<NH3<PH3<SiH4 |
分析 A.碳酸与NaClO可发生强酸制取弱酸的反应;
B.非金属性越强,电负性越强;
C.-OH、-COOH处于对位,易形成分子间氢键;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.碳酸与NaClO可发生强酸制取弱酸的反应,则酸性:HClO<H2CO3,故A错误;
B.非金属性越强,电负性越强,则电负性:O>N>C,故B错误;
C.-OH、-COOH处于对位,易形成分子间氢键,则晶体熔点的高低为 ,故C正确;
,故C正确;
D.非金属性越强,对应氢化物越稳定,则稳定性:H2O>NH3>PH3>SiH4,故D错误;
故选C.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
2. 将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
 将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )| A. | 镁比铝活泼,镁失去电子被氧化成Mg2+ | |
| B. | 铝是电池负极,开始工作时溶液中会立即有白色沉淀生成 | |
| C. | 该装置的内、外电路中,均是电子的定向移动形成电流 | |
| D. | 该装置开始工作时,铝片表面的氧化膜可不必处理 |
9.以下反应最符合绿色化学原子经济要求的是( )
| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 以铁和浓HNO3为原料生产硝酸铁 | D. | 用碳来还原氧化铁 |
6.若溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | Al3+ Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ NH4+ SO42- NO3- |
3.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 9gD2O 中含有的电子数为 5NA | |
| B. | 92gNO2和 N2O4混合气体中含有原子数为 6NA | |
| C. | 1molC3H8分子中共价键总数为 8 NA | |
| D. | 65 g Zn 全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为 NA |
4.从海带灰里提取单质碘的实验过程中,所涉及装置、操作正确且能达到实验目的是( )
| A. | 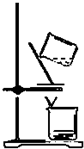 用图所示装置,过滤海带灰浸取液 | |
| B. | 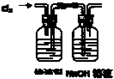 用图所示装置,在滤液中通入Cl2置换I2 | |
| C. | 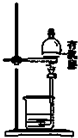 用图所示装置,先放出下层液体,再放出有机层 | |
| D. | 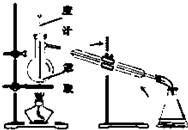 用图所示装置,回收萃取剂苯并获得单质碘 |
 A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.
A、B、C、D、E为周期表中原子序数依次递增的前四周期元素.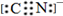 ,
,