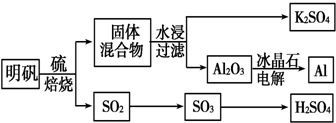
题目内容
4.无机化学命名委员会在1989年作出决定:把周期表原先的主、副族号取消,由左到右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列.按这个规定,下列说法正确的是( )| A. | 第3列元素种类最多 | |
| B. | 每一列都有非金属元素 | |
| C. | 从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
分析 由左到右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列,第3列含锕系和镧系,第2列及过渡元素均为金属元素,结合同主族元素的性质来解答.
解答 解:A.第3列含锕系和镧系,元素种类最多,故A正确;
B.第2列及过渡元素均为金属元素,不含非金属元素,故B错误;
C.由元素周期律可知,从上到下第1列元素的单质熔点逐渐降低,而第17列元素的单质熔点逐渐升高,故C错误;
D.He的最外层电子数为2,Fe的最外层电子数为2,第2列元素的原子最外层有2个电子,故D错误;
故选A.
点评 本题考查周期表的结构及应用,为高频考点,侧重于学生的分析能力、应用能力的考查,把握周期表的结构、元素周期律为解答的关键,题目难度不大.

练习册系列答案
相关题目
14.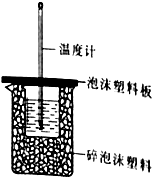 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
①从实验装置上看,图中尚缺少的一种仪器是环形玻璃搅拌棒.
②大烧杯上如不盖硬纸板,则求得的中和热数值偏小(填“偏大”、“偏小’、“无影响”)
③实验中,所用NaOH稍过量的原因是保证盐酸能够完全被中和.
(2)某化学二兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大.小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证.
①猜想Ⅰ:此反应过程放热,促使反应速率加快;(填放热或吸热)
②草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
③猜想Ⅱ可是:生成的Mn2+对该反应有催化作用,加快反应速率,要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂X及秒表,试剂X是B.
A.K2MnO4 B.MnSO4 C.MnO2
④基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.①从实验装置上看,图中尚缺少的一种仪器是环形玻璃搅拌棒.
②大烧杯上如不盖硬纸板,则求得的中和热数值偏小(填“偏大”、“偏小’、“无影响”)
③实验中,所用NaOH稍过量的原因是保证盐酸能够完全被中和.
(2)某化学二兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大.小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证.
①猜想Ⅰ:此反应过程放热,促使反应速率加快;(填放热或吸热)
②草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
③猜想Ⅱ可是:生成的Mn2+对该反应有催化作用,加快反应速率,要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂X及秒表,试剂X是B.
A.K2MnO4 B.MnSO4 C.MnO2
④基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4,少量X |
| 实验现象 (间) | A大于B(填大于或小于) | |
| 结论 | 猜想Ⅱ正确 | |
15.某微粒用AZRn+表示,下列关于该微粒的叙述不正确的是( )
| A. | 所含质子数=z | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=A |
12.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s末的v(H2)=0.3mol•L-1•s-1,则3s末NH3的浓度为( )
| A. | 0.4 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.9 mol•L-1 | D. | 1.2 mol•L-1 |
16.下列热化学方程式能表示可燃物的燃烧热的是( )
| A. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l)△H=-5518kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |
13.长式周期表共有18个纵列,从左到右排为1~18列,即碱金属为第1列,稀有气体元素为第18列.按这种规定,下列说法正确的是( )
| A. | 第14列元素中未成对电子数是同周期元素中最多的 | |
| B. | 只有第2列的元素原子最外层电子排布为ns2 | |
| C. | 第四周期第8列元素是铁元素 | |
| D. | 第15列元素原子的价电子排布为ns2np5 |
 氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成催化剂.
氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成催化剂. (1)指出图装置中A、B的名称
(1)指出图装置中A、B的名称