题目内容
12.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s末的v(H2)=0.3mol•L-1•s-1,则3s末NH3的浓度为( )| A. | 0.4 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.9 mol•L-1 | D. | 1.2 mol•L-1 |
分析 利用速率之比等于化学计量数之比计算v(NH3),再利用△c=v△t计算3s末NH3的浓度,据此进行解答.
解答 解:发生反应为N2+3H2?2NH3,3s内氢气的平均速率:v(H2)=0.3mol/(L•s),
利用速率之比等于化学计量数之比可知:v(NH3)=$\frac{2}{3}$×v(H2)=$\frac{2}{3}$×0.3mol/(L•s)=0.2mol/(L•s),
故3s末NH3的浓度为:0.2mol/(L•s)×3s=0.6mol/L,
故选B.
点评 本题考查了化学反应速率的计算,题目难度不大,明确化学反应速率与化学计量数的关系为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
3.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了以下四种不同的方案,其中方法和现象判断正确的是( )
| A. | 分别加入1mol/L的盐酸溶液,看有无气泡产生 | |
| B. | 分别取样配成溶液,滴加Ca(OH)2溶液,观察有无白色沉淀 | |
| C. | 用铂丝粘取固体在酒精灯火焰上灼烧,观察火焰的颜色,NaHCO3的焰色为紫色 | |
| D. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 |
20.金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度.其单质和化合物具有广泛的应用价值.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1).

图1中的M是短周期金属元素,M的部分电离能如下表:
请回答下列问题:
(1)Ti的基态原子外围电子排布式为4d25s2;
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C;

(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$ g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个;
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为TiN>CaO>KCl.

图1中的M是短周期金属元素,M的部分电离能如下表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(1)Ti的基态原子外围电子排布式为4d25s2;
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C;

(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$ g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个;
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
4.无机化学命名委员会在1989年作出决定:把周期表原先的主、副族号取消,由左到右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列.按这个规定,下列说法正确的是( )
| A. | 第3列元素种类最多 | |
| B. | 每一列都有非金属元素 | |
| C. | 从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
1.有A、B两种烃,其相关信息如下
回答下列问题:
(1)烃A的最简式是CH;
(2)烃A的结构简式是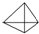 ;
;
(3)烃B的3种二溴代物的结构简式为CHBr2CH(CH3)2;CH2BrCBr(CH3)2;CH2BrCH(CH3)CH2Br.
| A | 完全燃烧的产物中n(CO2):n(H2O)=2:1 28<Mr(A)<60 不能使溴的四氯化碳溶液褪色 一氯代物只有1种结构 |
| B | 饱和链烃,通常情况下呈气态 二溴代物有3种 |
(1)烃A的最简式是CH;
(2)烃A的结构简式是
 ;
;(3)烃B的3种二溴代物的结构简式为CHBr2CH(CH3)2;CH2BrCBr(CH3)2;CH2BrCH(CH3)CH2Br.
2.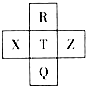 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:R>Q |
 4-甲基-1-戊炔
4-甲基-1-戊炔 3,3,4=三甲基己烷.
3,3,4=三甲基己烷.