题目内容
13.长式周期表共有18个纵列,从左到右排为1~18列,即碱金属为第1列,稀有气体元素为第18列.按这种规定,下列说法正确的是( )| A. | 第14列元素中未成对电子数是同周期元素中最多的 | |
| B. | 只有第2列的元素原子最外层电子排布为ns2 | |
| C. | 第四周期第8列元素是铁元素 | |
| D. | 第15列元素原子的价电子排布为ns2np5 |
分析 A.未成对电子数最多的元素,d能级有5个电子;
B.第18列He元素最外层电子排布为1s2;
C.第四周期第8列元素的原子序数为26;
D.第15列元素原子的价电子排布为ns2np3.
解答 解:A.未成对电子数最多的元素,d能级有5个电子,应为第5列,故A错误;
B.第18列He元素最外层电子排布为1s2,故B错误;
C.第四周期第8列元素的原子序数为26,为铁元素,故C正确;
D.第15列元素原子的价电子排布为ns2np3,最外层5个电子,故D错误.
故选C.
点评 本题考查元素周期表的结构、位置与结构关系,难度不大,注意整体把握元素周期表、注意元素的特殊性.

练习册系列答案
相关题目
3.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了以下四种不同的方案,其中方法和现象判断正确的是( )
| A. | 分别加入1mol/L的盐酸溶液,看有无气泡产生 | |
| B. | 分别取样配成溶液,滴加Ca(OH)2溶液,观察有无白色沉淀 | |
| C. | 用铂丝粘取固体在酒精灯火焰上灼烧,观察火焰的颜色,NaHCO3的焰色为紫色 | |
| D. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 |
4.无机化学命名委员会在1989年作出决定:把周期表原先的主、副族号取消,由左到右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列.按这个规定,下列说法正确的是( )
| A. | 第3列元素种类最多 | |
| B. | 每一列都有非金属元素 | |
| C. | 从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
1.有A、B两种烃,其相关信息如下
回答下列问题:
(1)烃A的最简式是CH;
(2)烃A的结构简式是 ;
;
(3)烃B的3种二溴代物的结构简式为CHBr2CH(CH3)2;CH2BrCBr(CH3)2;CH2BrCH(CH3)CH2Br.
| A | 完全燃烧的产物中n(CO2):n(H2O)=2:1 28<Mr(A)<60 不能使溴的四氯化碳溶液褪色 一氯代物只有1种结构 |
| B | 饱和链烃,通常情况下呈气态 二溴代物有3种 |
(1)烃A的最简式是CH;
(2)烃A的结构简式是
 ;
;(3)烃B的3种二溴代物的结构简式为CHBr2CH(CH3)2;CH2BrCBr(CH3)2;CH2BrCH(CH3)CH2Br.
8.某短周期非金属元素,其原子核外最外层电子数是次外层电子数的一半,该元素( )
| A. | 在自然界中以化合态的形式存在 | B. | 单质常用作半导体材料 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
18.分类是科学研究的重要方法,下列物质分类不正确的是( )
| A. | 化合物:干冰、冰水共存物、烧碱、小苏打 | |
| B. | 非电解质:乙醇、四氯化碳、氯气、葡萄糖 | |
| C. | 同素异形体:活性炭、C60、石墨烯、金刚石 | |
| D. | 混合物:铝热剂、纯净矿泉水、分析纯盐酸、漂白粉 |
2.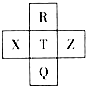 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:R>Q |
