题目内容
16.下列热化学方程式能表示可燃物的燃烧热的是( )| A. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l)△H=-5518kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |
分析 燃烧热表示1mol可燃物完全燃烧生成稳定氧化物所放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物,据此进行解答.
解答 解:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,
A.燃烧热表示1mol可燃物完全燃烧生成稳定氧化物放出的热量,HCl不是氧化物,故不符合燃烧热的定义,故A错误;
B.H2O的状态为气态,不是最稳定的氧化物,所以△H不代表燃烧热,故B错误;
C.应该是1mol C8H18(g)燃烧,即C8H18的系数应该为1,故C错误;
D.CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol中CO系数为1,生成产物为二氧化碳,为稳定的氧化物,符合燃烧热的定义,所以可表示CO燃烧热的热化学方程式,故D正确,
故选D.
点评 本题考查热化学方程式的书写方法,题目难度中等,理解燃烧热的概念是解答关键,注意可燃物的物质的量必须是1mol,生成的产物必须是稳定氧化物,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
6.下列电子书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
4.无机化学命名委员会在1989年作出决定:把周期表原先的主、副族号取消,由左到右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列.按这个规定,下列说法正确的是( )
| A. | 第3列元素种类最多 | |
| B. | 每一列都有非金属元素 | |
| C. | 从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
11.下列原子中,半径最小的是( )
| A. | F | B. | Cl | C. | Al | D. | I |
1.有A、B两种烃,其相关信息如下
回答下列问题:
(1)烃A的最简式是CH;
(2)烃A的结构简式是 ;
;
(3)烃B的3种二溴代物的结构简式为CHBr2CH(CH3)2;CH2BrCBr(CH3)2;CH2BrCH(CH3)CH2Br.
| A | 完全燃烧的产物中n(CO2):n(H2O)=2:1 28<Mr(A)<60 不能使溴的四氯化碳溶液褪色 一氯代物只有1种结构 |
| B | 饱和链烃,通常情况下呈气态 二溴代物有3种 |
(1)烃A的最简式是CH;
(2)烃A的结构简式是
 ;
;(3)烃B的3种二溴代物的结构简式为CHBr2CH(CH3)2;CH2BrCBr(CH3)2;CH2BrCH(CH3)CH2Br.
8.某短周期非金属元素,其原子核外最外层电子数是次外层电子数的一半,该元素( )
| A. | 在自然界中以化合态的形式存在 | B. | 单质常用作半导体材料 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
15.A、B、D、E、G、J六种短周期主族元素,原子半径依次减小.A、E、J位于相邻的不同周期,有机化合物均含有E元素.
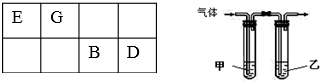
(1)常见发酵粉、加碘盐、味精及某些食品防腐剂的主要成分都含有金属元素A的离子.A离子的结构示意图为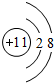 .
.
(2)写出E2J4与水反应的化学方程式CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;其反应类型为加成反应.
(3)利用右图装置设计一简单实验证明元素非金属性D>B.甲中应盛放某种弱电解质的溶液,其溶质的化学式为H2S,所通入气体与乙中某强电解质溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)元素D的最高价氧化物为无色液体,0.20mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量,该反应的热化学方程式为Cl2O7(l)+H2O(l)=HClO4(aq)△H=-QkJ/mol.
(5)G的最简单氢化物溶于水得溶液X,D的氢化物溶于水得溶液Y.常温下,将X、Y等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
①组混合溶液中由水电离出的c(H+)=10-5mol•L-1.
②组混合溶液中各离子浓度由大到小的顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+).

(1)常见发酵粉、加碘盐、味精及某些食品防腐剂的主要成分都含有金属元素A的离子.A离子的结构示意图为
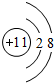 .
.(2)写出E2J4与水反应的化学方程式CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;其反应类型为加成反应.
(3)利用右图装置设计一简单实验证明元素非金属性D>B.甲中应盛放某种弱电解质的溶液,其溶质的化学式为H2S,所通入气体与乙中某强电解质溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)元素D的最高价氧化物为无色液体,0.20mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量,该反应的热化学方程式为Cl2O7(l)+H2O(l)=HClO4(aq)△H=-QkJ/mol.
(5)G的最简单氢化物溶于水得溶液X,D的氢化物溶于水得溶液Y.常温下,将X、Y等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
| 实验编号 | X物质的量浓度(mol•L-1) | Y物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | 0.2 | 0.1 | pH>7 |
②组混合溶液中各离子浓度由大到小的顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+).
 4-甲基-1-戊炔
4-甲基-1-戊炔 3,3,4=三甲基己烷.
3,3,4=三甲基己烷.