题目内容
9.将一定量的钠铝合金置于水中,合金全部溶解,得到20mL c(OH-)=1mol/L的溶液,然后向溶液中滴加l mol•L-1的盐酸至沉淀质量最大时,消耗盐酸40mL,原合金中钠的质量为( )| A. | 0.46g | B. | 0.69g | C. | 0.92g | D. | 0.23g |
分析 将一定量的钠铝合金置于水中,合金全部溶解,得到20mL c(OH-)=1mol/L的溶液,溶液呈碱性,故溶液中溶质为氢氧化钠、偏铝酸钠,向溶液中加入lmol•L-1的盐酸滴定,至沉淀质量最大时,此时溶液中溶质为氯化钠,根据溶液中电荷守恒可知n(Na+)=n(Cl-),据此计算.
解答 解:将一定量的钠铝合金置于水中,合金全部溶解,得到20mLc(OH-)=1mol/L的溶液,溶液呈碱性,故溶液中溶质为氢氧化钠、偏铝酸钠,向溶液中加入lmol•L-1的盐酸滴定,至沉淀质量最大时,此时溶液中溶质为氯化钠,根据溶液中电荷守恒可知n(Na+)=n(Cl-)=0.04mol×1mol/L=0.04mol,根据钠元素守恒可知原合金中钠为0.04mol,所以原合金中钠的质量为0.04mol×23g/mol=0.92g,
故选:C.
点评 考查钠铝及其化合物的性质、根据方程式的计算等,难度中等,利用守恒计算,清楚反应过程判断n(Na+)=n(Cl-)是解题关键.

练习册系列答案
相关题目
19.化学与生活、生产密切相关,下列说法正确的是( )
| A. | 煤的气化和液化都是物理变化,向煤中加入适量CaSO4,可大大减少产物中SO2的量 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | PM 2.5、二氧化碳都属于空气质量日报的内容 | |
| D. | Na、K合金熔点低,可用作原子反应堆的导热剂 |
20.硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如下图所示.下列说法正确的是( )


| A. | 正反应为放热反应 | |
| B. | 图中P点:v(正)>v(逆) | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.016mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
17.某学习小组按如下实验流程测定摩尔盐样品的组成.
实验一:称取3.9200g摩尔盐样品配制250mL溶液.
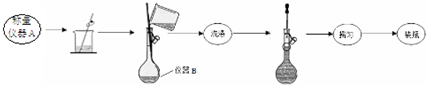
实验二:测定摩尔盐样品组成的方案如下:
①取少量配制液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀.
②另取少量配制液,加入KSCN溶液,无明显现象.
③定量测定实验如下:
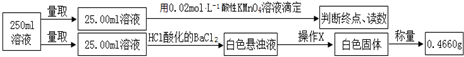
滴定实验结果记录如下:
请回答问题
(1)实验一中仪器名称:仪器A电子天平、仪器B250mL容量瓶.
(2)写出实验一中摇匀的实验操作把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒摇动多次,使溶液混合均匀.
(3)实验二③中操作X为过滤、洗涤、干燥或烘干(冷却)((按操作顺序填写).
(4)实验二③中滴定时发生反应的离子方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,滴定终点的现象是最后一滴溶液滴入,溶液出现浅紫红色,30秒不褪色.
(5)通过上述实验能否确定摩尔盐样品的组成能(填“能”、“不能”),若能
请写出化学式,若不能请说明理由(NH4)2SO4•FeSO4•6H2O或(NH4)2Fe(SO4)2•6H2O.
实验一:称取3.9200g摩尔盐样品配制250mL溶液.

实验二:测定摩尔盐样品组成的方案如下:
①取少量配制液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀.
②另取少量配制液,加入KSCN溶液,无明显现象.
③定量测定实验如下:

滴定实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
(1)实验一中仪器名称:仪器A电子天平、仪器B250mL容量瓶.
(2)写出实验一中摇匀的实验操作把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒摇动多次,使溶液混合均匀.
(3)实验二③中操作X为过滤、洗涤、干燥或烘干(冷却)((按操作顺序填写).
(4)实验二③中滴定时发生反应的离子方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,滴定终点的现象是最后一滴溶液滴入,溶液出现浅紫红色,30秒不褪色.
(5)通过上述实验能否确定摩尔盐样品的组成能(填“能”、“不能”),若能
请写出化学式,若不能请说明理由(NH4)2SO4•FeSO4•6H2O或(NH4)2Fe(SO4)2•6H2O.
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D20的混合物中所含中子数为NA | |
| B. | 等物质的量的水与重水含有的中子数相等 | |
| C. | 18gD20和18gH20中含有的质子数均为10NA | |
| D. | 235g核素$\left.\begin{array}{l}{235}\\{92}\end{array}\right.$U发生裂变反应:$\left.\begin{array}{l}{235}\\{92}\end{array}\right.$U+$\left.\begin{array}{l}{1}\\{0}\end{array}\right.$n$\frac{\underline{\;裂变\;}}{\;}$$\left.\begin{array}{l}{90}\\{38}\end{array}\right.$Sr+$\left.\begin{array}{l}{136}\\{54}\end{array}\right.$U+10$\left.\begin{array}{l}{1}\\{0}\end{array}\right.$n净产生的中子($\left.\begin{array}{l}{1}\\{0}\end{array}\right.$n)数为10NA |
4.分子式为C3H4Cl2的链状有机物有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
11.某合金(仅含铜、铁),将其全部投入稀硝酸溶液中,加热使其充分反应,下列说法正确的是( )
| A. | 若金属有剩余,在溶液中再滴入硫酸后,金属不溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若金属全部溶解,则溶液中一定含有Fe2+ | |
| D. | 若金属有剩余,不可能只有铁 |
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42- | |
| B. | c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO- | |
| C. | 能使pH试纸变红的溶液中:K+、Ba2+、AlO2-、Cl- | |
| D. | pH=0的溶液中:Mg2+、Na+、F-、SO42- |
 )是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
)是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:

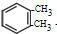 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$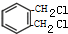 +2HCl.
+2HCl. .
.