题目内容
8.邻苯二甲酸二乙酯(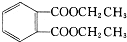 )是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
)是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法: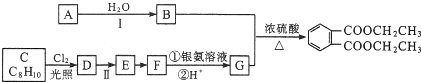
已知以下信息:
①有机化合物A可用来催熟水果.
②有机化合物C的核磁共振氢谱显示其有3种不同化学环境的氢原子.
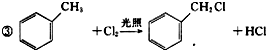
(1)A的化学名称是乙烯,B的结构简式为CH3CH2OH.
(2)反应Ⅱ的试剂是强碱的水溶液,该反应类型为取代反应或水解反应.
(3)C生成D的化学方程式为
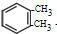 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$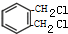 +2HCl.
+2HCl.(4)E生成F的化学方程式为
 .
.(5)在G的同分异构体中,既能与新制的Cu(OH)2悬浊液在加热条件下反应生成砖红色沉淀,又能与碳酸钠反应生成二氧化碳,还能使FeCl3溶液显色的有10种,所有这些同分异构体中,不同化学环境氢原子的种数相同(填“相同”“不相同”).
分析 由邻苯二甲酸二乙酯结构可知,邻苯二甲酸和乙醇发生酯化反应生成,有机化合物A可用来催熟水果,A为CH2=CH2,CH2=CH2中含有不饱和的C=C双键,能够在催化剂存在条件下与水发生加成反应生成B为CH3CH2OH;
G为邻苯二甲酸 ,含几种位置的H原子,则核磁共振氢谱就有几种,有机化合物C化学式为C8H10,核磁共振氢谱显示有3种不同化学环境的氢原子,说明含有3种氢原子,则C为
,含几种位置的H原子,则核磁共振氢谱就有几种,有机化合物C化学式为C8H10,核磁共振氢谱显示有3种不同化学环境的氢原子,说明含有3种氢原子,则C为 ,与氯气发生取代反应生成D为
,与氯气发生取代反应生成D为 ,F能发生银镜反应,说明F为醛,且G为邻苯二甲酸,所以F
,F能发生银镜反应,说明F为醛,且G为邻苯二甲酸,所以F ,则E→F为醇的催化氧化,所以E为
,则E→F为醇的催化氧化,所以E为 ,D→E为卤代烃的取代反应,据此分析解答.
,D→E为卤代烃的取代反应,据此分析解答.
解答 解:由邻苯二甲酸二乙酯结构可知,邻苯二甲酸和乙醇发生酯化反应生成,有机化合物A可用来催熟水果,A为CH2=CH2,CH2=CH2中含有不饱和的C=C双键,能够在催化剂存在条件下与水发生加成反应生成B为CH3CH2OH;
G为邻苯二甲酸 ,含几种位置的H原子,则核磁共振氢谱就有几种,有机化合物C化学式为C8H10,核磁共振氢谱显示有3种不同化学环境的氢原子,说明含有3种氢原子,则C为
,含几种位置的H原子,则核磁共振氢谱就有几种,有机化合物C化学式为C8H10,核磁共振氢谱显示有3种不同化学环境的氢原子,说明含有3种氢原子,则C为 ,与氯气发生取代反应生成D为
,与氯气发生取代反应生成D为 ,F能发生银镜反应,说明F为醛,且G为邻苯二甲酸,所以F
,F能发生银镜反应,说明F为醛,且G为邻苯二甲酸,所以F ,则E→F为醇的催化氧化,所以E为
,则E→F为醇的催化氧化,所以E为 ,D→E为卤代烃的取代反应,
,D→E为卤代烃的取代反应,
(1)A的化学名称是乙烯,B为乙醇,结构简式为CH3CH2OH,故答案为:乙烯;CH3CH2OH;
(2)反应II为卤代烃的水解反应,其反应条件是强碱的水溶液、加热,所以所用试剂是强碱水溶液,该反应为取代反应或水解反应,故答案为:强碱的水溶液;取代(或水解);
(3)有机化合物C化学式为C8H10,核磁共振氢谱显示有3种不同化学环境的氢原子,说明含有3种氢原子,则C为 ,与氯气发生取代反应
,与氯气发生取代反应 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$ +2HCl,
+2HCl,
故答案为: +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$ +2HCl;
+2HCl;
(4)E生成F为醇的催化氧化,反应方程式为 ,故答案为:
,故答案为: ;
;
(5)G为邻苯二甲酸 ,满足下列条件的同分异构体:
,满足下列条件的同分异构体:
能与新制的Cu(OH)2 悬浊液混合加热生成砖红色沉淀,含有醛基,又能与碳酸钠反应生成二氧化碳,含有羧基,能与FeCl3 溶液发生显色反应,含有酚羟基;说明苯环上有-OH、-CHO、-COOH三个取代基,-OH、-CHO处于邻位,-COOH有4种位置,-OH、-CHO处于间位,-COOH有4种位置,-OH、-CHO处于对位,-COOH有2种位置,有10种;所有这些同分异构体中,不同化学环境氢原子的种数都为6种,
故答案为:10;相同.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析判断及知识综合应用能力,根据某些物质结构简式结合反应条件、题给信息进行推断,难点是同分异构体种类判断,要考虑位置异构、碳链异构,题目难度中等.

| A. | 0.46g | B. | 0.69g | C. | 0.92g | D. | 0.23g |
| A. | H2O2→H2O | B. | NH4+→NH3 | C. | Fe3+→Fe2+ | D. | CO→CO2 |
| A. | 均为0.56 L | B. | ①=② | C. | ①>② | D. | ②>① |
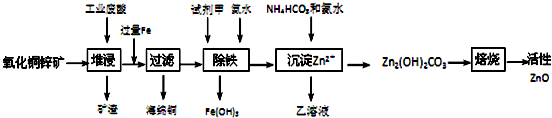
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)< Ksp(ZnS)(选填“>”“<”或“=”).
(2)你认为在除铁过程中选用下列物质中的C(填序号)作为试剂甲是比较合适的.
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)请写出加甲物质后,加入氨水控制调节溶液的pH生成Fe(OH)3反应的离子方程式Fe3++3NH3•H2O═Fe﹙OH)3↓+3NH4+.
(5)298K时残留在乙溶液中的c(Fe3+)在2.7×10-15.6 mol/L以下(Fe(OH)3的KSP=2.70×10-39)
(6)乙的溶液可直接用作氮肥,则乙的化学式是(NH4)2SO4.
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式2ZnSO4+NH4HCO3+3NH3.H2O═Zn2(OH)2CO3↓+2(NH4)2SO4+H2O.
| A. | 能使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、Cl-、S2- | |
| B. | 在pH=11的溶液中:Na+、AlO2-、NO3-、S2-、SO32- | |
| C. | 室温下,由水电离的c(H+)=10-10mol/L的溶液中:Cl-、HCO3-、NO3-、NH4+、F- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:K+、Na+、AlO2-、SCN- |
| 选项 | 离子组 | 评 价 |
| A | H+、Fe2+、NO3-、Cl- | 不能大量共存于同一溶液中,因为发生了氧化还原反应: 4Fe2++2NO3-+6H+═4Fe3++2NO↑+3H2O |
| B | Na+、CO32-、Cl-、Al3+ | 不能大量共存于同一溶液中,因Al3+和CO32-都要发生水解且相互促进:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
| C | Fe3+、K+、SCN-、Br- | 不能大量共存于同一溶液中,因为有红色沉淀生成: Fe3++3SCN-═Fe(SCN)3↓ |
| D | HCO3-、OH-、Na+、Ca2+ | 不能大量共存于同一溶液中,因会发生如下反应: HCO3-+OH-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
 化学是一门以实验为基础的学科.
化学是一门以实验为基础的学科.