题目内容
19.化学与生活、生产密切相关,下列说法正确的是( )| A. | 煤的气化和液化都是物理变化,向煤中加入适量CaSO4,可大大减少产物中SO2的量 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | PM 2.5、二氧化碳都属于空气质量日报的内容 | |
| D. | Na、K合金熔点低,可用作原子反应堆的导热剂 |
分析 A、煤的气化是用煤做原料生产水煤气;煤的液化是用煤做原料来生产甲醇;
B、可溶性钡盐能使人重金属中毒;
C、二氧化碳不是大气污染物;
D、钠钾合金的导热性良好.
解答 解:A、煤的气化是用煤做原料生产水煤气;煤的液化是用煤做原料来生产甲醇,故均为化学变化;为了减少燃煤时二氧化硫的排放,可在燃煤中放入CaCO3,故A错误;
B、可溶性钡盐能使人重金属中毒,即Ba2+对人体有毒,但由于硫酸钡难溶,故对人体无毒,可做钡餐,故B错误;
C、二氧化碳不是大气污染物,故不在空气质量日报的范围内,故C错误;
D、Na-K合金作熔点低,导热性好,所以用Na-K合金作原子反应堆的导热剂,故D正确.
故选D.
点评 本题以物质的用途为载体考查了煤的综合利用、合金的用途等,难度不大,了解物质的性质和用途是关键.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
9.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 红磷在氯气中反应,1mol红磷失去的电子数一定为5NA | |
| B. | 标准状况下22.4L C3H8中含中子数为18NA | |
| C. | 1L 1mol/L的葡萄糖溶液中,含有的分子数为NA个 | |
| D. | 常温下78 g过氧化钠和122 g水混合,所得溶液质量分数为40% |
10.化学概念在逻辑上存在如图所示关系,对下列概念的说法正确的是( )

| A. | 溶液与胶体属于包含关系 | |
| B. | 化合物与氧化物属于包含关系 | |
| C. | 电解质与化合物属于交叉关系 | |
| D. | 氧化还原反应与化合反应属于并列关系 |
7.炼铝厂的废料中主要含Al、Al2O3及少量SiO2和FeO•xFe2O3,可用于制备明矾[KAl(SO4)2•12H2O].工艺流程如下:
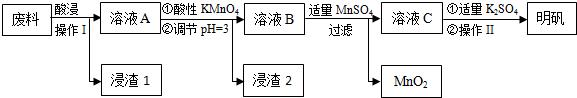
(1)“酸浸”过程中的应选择H2SO4(写酸的化学式).为提高浸出速率,除适当增大酸的浓度外,还可采取的措施有提高反应温度、粉碎等.(写出两条)
(2)操作Ⅰ是过滤,操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)在溶液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+)5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
调节pH=3的目的是使Fe3+转化成Fe(OH)3沉淀,防止Al3+沉淀.此步骤中,可以用H2O2代替KMnO4,写出H2O2的电子式 .
.
(4)只用一种试剂检验溶液A中是否存在Fe2+,该试剂是高锰酸钾酸性溶液或铁氰化钾溶液(写名称).
(5)己知在pH=3、加热条件下,加入MnSO4发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2+4H+.

(1)“酸浸”过程中的应选择H2SO4(写酸的化学式).为提高浸出速率,除适当增大酸的浓度外,还可采取的措施有提高反应温度、粉碎等.(写出两条)
(2)操作Ⅰ是过滤,操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)在溶液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+)5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
 .
.(4)只用一种试剂检验溶液A中是否存在Fe2+,该试剂是高锰酸钾酸性溶液或铁氰化钾溶液(写名称).
(5)己知在pH=3、加热条件下,加入MnSO4发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2+4H+.
11.下列过程所涉及到的反应不会出现氧化还原反应的是( )
| A. | 金属钠久置于空气中,先变暗,再变白,又“出汗”,最后变成白色固体 | |
| B. | 由海水制备金属镁和游离态的溴 | |
| C. | 工业上用石灰石、石英、纯碱制玻璃 | |
| D. | 高温下用二氧化硅和碳反应制备粗硅 |
9.将一定量的钠铝合金置于水中,合金全部溶解,得到20mL c(OH-)=1mol/L的溶液,然后向溶液中滴加l mol•L-1的盐酸至沉淀质量最大时,消耗盐酸40mL,原合金中钠的质量为( )
| A. | 0.46g | B. | 0.69g | C. | 0.92g | D. | 0.23g |



