题目内容
13.对热化学方程式C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1最准确的理解是( )| A. | 1 mol碳和1 mol水蒸气反应生成1 mol CO和1 mol H2,同时吸收131.3 kJ热量 | |
| B. | 1 mol碳和1 mol水反应生成1 molCO和 1 mol H2,同时放出131.3 kJ热量 | |
| C. | 固体碳和水蒸汽反应吸收131.3 kJ热量 | |
| D. | 1个碳原子和1个水分子反应,吸热131.1 kJ |
分析 A、据热化学方程式的含义解答;
B、反应吸热,不是放热反应;
C、反应的热量变化和反应物、生成物物质的量、聚集状态有关;
D、热化学方程式的化学计量数只表示物质的量.
解答 解:A、1mol固态焦炭与1mol水蒸气反应产生一氧化碳气体和氢气,吸收131.3 kJ的热量,故A正确;
B、1mol碳和1mol水反应吸收131.3 kJ的热量,故B错误;
C、碳与水反应吸收131.3 kJ的热量,未指明物质的量和聚集状态,故C错误;
D、热化学方程式的化学计量数只表示物质的量,不表示分子个数,故D错误;
故选A.
点评 本题考查了热化学方程式的书写方法和表达意义,注意物质聚集状态、物质的量和焓变对应,题目较简单.

练习册系列答案
相关题目
3.如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )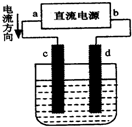

| A. | d为负极、c为正极 | B. | c电极上发生还原反应有气体产生 | ||
| C. | 电解过程中,氯离子向d电极移动 | D. | 电解过程中,d电极质量增加 |
1.下列表述正确的是( )
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| B. | 中和等体积、等pH的盐酸和CH3COOH溶液所消耗的NaOH物质的量相同 | |
| C. | 物质的量浓度相同的下列溶液:Na2CO3、KNO3、NH4Cl pH依次减小 | |
| D. | 将NH4Cl溶液蒸干制备NH4Cl固体 |
18.下列关于反应过程中能量变化的说法正确的是( )
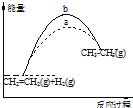

| A. | 图1的曲线说明该反应是放热反应,即CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0 | |
| B. | 化合反应都是放热反应,分解反应都是吸热反应 | |
| C. | 若图1表示有无使用催化剂时的反应进程,则b曲线使用,a曲线没使用 | |
| D. | 图中,若△H=QkJ•mol-1(Q>0),表示正反应活化能比逆反应活化能大QkJ•mol-1 |
5.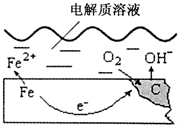 如图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2.Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈.请根据图示,回答下列问题:
如图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2.Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈.请根据图示,回答下列问题:
(1)在上述电化学腐蚀中,碳(C)作正极.
(2)写出负极的电极反应式Fe-2e-=Fe2+.
(3)工业上,常在钢铁设备的表面涂一层油,其作用是A.
A.减少钢铁与空气和水的接触,防止在钢铁表面形成微小原电池
B.隔绝钢铁与空气和水的接触,阻止在钢铁表面形成微小电解池
C.润滑设备,防止灰尘污染
D.防止人为接触设备,避免设备腐蚀
(4)如果将长期浸泡在河水中的钢铁闸门与外电源连接防腐,应将闸门连接外部直流电源的负极.
 如图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2.Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈.请根据图示,回答下列问题:
如图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2.Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈.请根据图示,回答下列问题:| 物质 | 熔点/°C | 沸点/°C | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
(2)写出负极的电极反应式Fe-2e-=Fe2+.
(3)工业上,常在钢铁设备的表面涂一层油,其作用是A.
A.减少钢铁与空气和水的接触,防止在钢铁表面形成微小原电池
B.隔绝钢铁与空气和水的接触,阻止在钢铁表面形成微小电解池
C.润滑设备,防止灰尘污染
D.防止人为接触设备,避免设备腐蚀
(4)如果将长期浸泡在河水中的钢铁闸门与外电源连接防腐,应将闸门连接外部直流电源的负极.
2.下列关于Na2CO3和NaHCO3的说法中,正确的是( )
| A. | 相同温度下在水中的溶解度:Na2CO3<NaHCO3 | |
| B. | 相同浓度时pH大小关系为:Na2CO3<NaHCO3 | |
| C. | 等质量的两种固体,分别与过量盐酸反应,生成CO2的质量碳酸氢钠多 | |
| D. | 分别取1mol/L的两种溶液,滴入氯化钙溶液,两个皆有沉淀产生 |
3.下列措施对增大反应速率明显有效的是( )
| A. | Na 与水反应时,增大水的用量 | |
| B. | Fe 与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | 做铝与氧气反应的实验时,将铝片改为铝粉 |