题目内容
8.下列金属防腐的措施中,①水中的钢闸门连接电源的负极使用的是外加电源的阴极保护法法;②地下钢管连接镁块使用的是牺牲阳极的阴极保护法法.分析 水中的钢闸门连接电源的负极,为外加电源的阴极保护法,地下钢管连接镁块,构成原电池,Mg活泼作负极,为牺牲阳极的阴极保护法.
解答 解:水中的钢闸门连接电源的负极,为外加电源的阴极保护法,为电化学保护法,故答案为:外加电源的阴极保护法;
地下钢管连接镁块,构成原电池,Mg活泼作负极,为牺牲阳极的阴极保护法,为电化学保护法,故答案为:牺牲阳极的阴极保护法.
点评 本题考查金属的性质及化学反应原理,为高频考点,把握物质的性质、发生的反应及电化学为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
18.两只敞口烧杯中分别发生如下反应:一只烧杯中反应为:A+B=C+D,反应温度为T1,另一只烧杯中反应为:M+N=P+Q,反应温度为T2,T1>T2,则两只烧杯中反应速率快慢为( )
| A. | 无法确定 | B. | 前者快 | C. | 后者快 | D. | 一样快 |
19.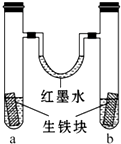 如图装置中,U形管内为红墨水,a、b试管内分别盛有 (显中性的)食盐水和(显酸性的)氯化铵溶液,各加入生铁(含C、Fe)块,a、b中均能构成原电池而使铁分别被O2和H+ 腐蚀,放置一段时间.下列有关描述错误的是( )
如图装置中,U形管内为红墨水,a、b试管内分别盛有 (显中性的)食盐水和(显酸性的)氯化铵溶液,各加入生铁(含C、Fe)块,a、b中均能构成原电池而使铁分别被O2和H+ 腐蚀,放置一段时间.下列有关描述错误的是( )
 如图装置中,U形管内为红墨水,a、b试管内分别盛有 (显中性的)食盐水和(显酸性的)氯化铵溶液,各加入生铁(含C、Fe)块,a、b中均能构成原电池而使铁分别被O2和H+ 腐蚀,放置一段时间.下列有关描述错误的是( )
如图装置中,U形管内为红墨水,a、b试管内分别盛有 (显中性的)食盐水和(显酸性的)氯化铵溶液,各加入生铁(含C、Fe)块,a、b中均能构成原电池而使铁分别被O2和H+ 腐蚀,放置一段时间.下列有关描述错误的是( )| A. | 生铁块中的碳是原电池的正极 | |
| B. | 红墨水柱两边的液面变为左低右高 | |
| C. | 两试管中相同的电极反应式是:Fe-2e-═Fe2+ | |
| D. | a试管中O2得电子,b试管中H+ 得电子 |
16.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ•mol-1,则含20.0g溶质的NaOH稀溶液与稀醋酸完全中和,放出的热量小于28.7kJ | |
| D. | 已知:2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
3.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2 H2S | B. | C2H4 CH4 | C. | C60 C2H4 | D. | NH3 HCl |
13.对热化学方程式C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1最准确的理解是( )
| A. | 1 mol碳和1 mol水蒸气反应生成1 mol CO和1 mol H2,同时吸收131.3 kJ热量 | |
| B. | 1 mol碳和1 mol水反应生成1 molCO和 1 mol H2,同时放出131.3 kJ热量 | |
| C. | 固体碳和水蒸汽反应吸收131.3 kJ热量 | |
| D. | 1个碳原子和1个水分子反应,吸热131.1 kJ |
20.下列说法正确的是( )
| A. | 钢铁发生电化学腐蚀时,负极反应都是Fe-3e-=Fe3+ | |
| B. | 镀锡的铁制品,若发生镀层破损,铁制品比受损前更容易锈蚀 | |
| C. | 铜的金属活动性比铁弱,可在海轮外壳上装上铜块以减缓船体腐蚀 | |
| D. | 钢铁发生吸氧腐蚀时,正极反应是:2H2O+O2+4e-=4OH- |
17.分类是学习和研究化学的一种重要方法,下列对于Na2O的分类合理的是( )
| A. | 属于盐 | B. | 属于碱 | C. | 属于酸 | D. | 属于氧化物 |
