题目内容
3.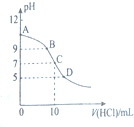 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | B、D两点溶液中水电离出来的c(OH-):B<0 | |
| D. | C点溶液中的H2O不发生电离 |
分析 A、A点溶液中加少量水,促进氨水的电离,在$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$的分子和分母同乘以氢氧根离子的浓度,得$\frac{{K}_{w}}{{K}_{b}•c(N{H}_{3}•{H}_{2}O)}$,由此分析解答;
B、C点等体积混合溶液呈中性,所以c(Cl-)=c(HCl)=c(NH4+)<c(NH3•H2O);
C、B点是氨水和氯化氨的混合溶液,对水的电离起抑制作用,水电离出的氢氧根离子等于溶液中的氢离子的浓度10-9mol/L,而D点是盐酸和氯化铵的混合物,对水的电离起抑制作用,水电离出的氢氧根离子等于溶液中的氢氧根离子的浓度10-9mol/L;
D、电解质水溶液中都存在水的电离.
解答 解:A、A点溶液中加少量水,促进氨水的电离,在$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$的分子和分母同乘以氢氧根离子的浓度,得$\frac{{K}_{w}}{{K}_{b}•c(N{H}_{3}•{H}_{2}O)}$,一水合氨的浓度减小,所以$\frac{{K}_{w}}{{K}_{b}•c(N{H}_{3}•{H}_{2}O)}$变大,故A错误;
B、C点等体积混合溶液呈中性,所以c(Cl-)=c(HCl)=c(NH4+)<c(NH3•H2O),所以氨水的物质的量浓度约为1.006×10-2mol•L-1,故B正确;
C、B点是氨水和氯化氨的混合溶液,对水的电离起抑制作用,水电离出的氢氧根离子等于溶液中的氢离子的浓度10-9mol/L,而D点是盐酸和氯化铵的混合物,对水的电离起抑制作用,水电离出的氢氧根离子等于溶液中的氢氧根离子的浓度10-9mol/L,所以B、D两点溶液中水电离出来的c(OH-):B=D,故C错误;
D、电解质水溶液中都存在水的电离,而不是水不发生电离,只不过电离程度大小不同,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡常数的计算等知识,题目难度中等,注意掌握盐的水解原理及其应用方法,明确电离平衡常数的概念及计算方法,试题培养了学生灵活应用所学知识的能力及化学计算能力.

 目标测试系列答案
目标测试系列答案| A. | 乙酸钾 | B. | 甲醇 | C. | 乙醇 | D. | 乙酸 |
Ⅰ.制取氯化锌主要工艺如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.9 | 8.9 |
| Fe2+ | 5.8 | 8.8 |
(1)为了加快反应,“酸溶”需要适当加热,但是温度不宜太高,原因是防止金属离子水解形成沉淀,以及温度过高H2O2发生分解.
(2)沉淀A的化学式为Cu.
(3)调节pH的范围为3.2≤pH<5.2;若试剂X为Zn2(OH)2CO3,加人X除杂质的离子方程为Zn2(OH)2CO3+4H+=2Zn2++3H2O+CO2↑.
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | M的所有原子可能在同一平面上 | |
| B. | N的二氯代物有5种同分异构体(不考虑立体异构) | |
| C. | W的分子式为C10H14 | |
| D. | M、N和W均能发生氧化反应和加成反应 |
| A. | 元素的非金属性:N<O<F | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 热稳定性:HF>HCl>H2S | D. | 原子半径:Al>Mg>Na |
| A. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| B. | 金属与浓硫酸或浓硝酸反应都不会产生氢气 | |
| C. | 每1 molCu参加反应就有2 mol浓 H2SO4被还原,同时生成2 mol SO2 | |
| D. | 浓硫酸因为有吸水性,可用来干燥HCl、SO2、Cl2等多种气体 |
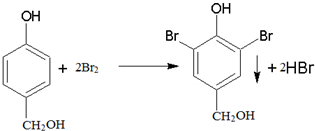 .
.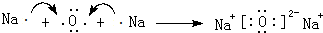 .
.