题目内容
19.乙酸乙酯在KOH溶液中水解,得到的产物是( )| A. | 乙酸钾 | B. | 甲醇 | C. | 乙醇 | D. | 乙酸 |
分析 乙酸乙酯水解生成乙酸和乙醇,其中乙酸与氢氧化钾溶液反应生成乙酸钾和水,所以乙酸乙酯在氢氧化钾溶液中水解得到的产物为乙酸钾和乙醇,据此进行判断.
解答 解:酯在碱溶液中完全水解,则乙酸乙酯在氢氧化钾溶液中发生水解生成乙酸钾和乙醇,反应的化学方程式为:CH3COOC2H5+KOH→CH3COOK+C2H5OH,
故选AC.
点评 本题考查了酯的性质及应用,题目难度不大,明确酯的水解原理为解答关键,注意熟练掌握常见有机物结构与性质,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.将铜棒和锌棒用导线连接后插入稀硫酸溶液中,下列叙述中正确的是( )
| A. | 该装置能形成原电池,其中锌是负极 | |
| B. | 该装置能形成原电池,其中铜是负极 | |
| C. | 该装置不能形成原电池 | |
| D. | 以上说法均不正确 |
10.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是( )
| A. | NH4H中 H+的核外电子排布与He相同 | |
| B. | NH4H溶于水,所形成的溶液显碱性 | |
| C. | NH4H固体投入少量的水中,有两种气体产生 | |
| D. | NH4H与水反应时,NH4H是氧化剂 |
14.下列变化属于物理变化的是( )
| A. | 石油裂解 | B. | 石油的分馏 | ||
| C. | 石油的裂化 | D. | 甲烷和氯气混合后光照 |
4.下列各组物质中一定互为同系物的是( )
| A. | C3H4;C5H8 | B. | C3H8;C5H12 | ||
| C. | CH3-CH2-CH2-CH3 ; | D. | C2H5Cl;C3H6Cl2 |
5.某温度下,按照下表数据进行浓度对化学反应速率的影响的实验:
(已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)
请回答:
(1)②中加3% Na2S2O3溶液4 mL.
(2)测得中出现浑浊的时间可能是c(填字母). a.42s b.30s c.16s
(3)上述实验结论是对于一个化学反应,在其他条件不变时,反应物的浓度越大,化学反应速率越大.
(已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)
| 试管编号 | 3% Na2S2O3溶液 | H2O | 稀H2SO4(体积比为1:5) | 出现浑浊时间 |
| ① | 3mL | 3mL | 5滴 | 33s |
| ② | 4mL | 2mL | 5滴 | 28s |
| ③ | 5mL | 1mL | 5滴 | cs |
(1)②中加3% Na2S2O3溶液4 mL.
(2)测得中出现浑浊的时间可能是c(填字母). a.42s b.30s c.16s
(3)上述实验结论是对于一个化学反应,在其他条件不变时,反应物的浓度越大,化学反应速率越大.
3.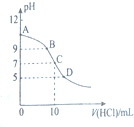 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | B、D两点溶液中水电离出来的c(OH-):B<0 | |
| D. | C点溶液中的H2O不发生电离 |