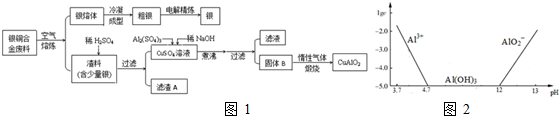
题目内容
14.某有机物A是芳香烃的含氧衍生物,其相对分子质量不超过130,A中含氧的质量为25.8%,该有机物的分子式为C7H8O2,若A苯环上的一氯代物有两种,则A有4种同分异构体,若1molA与足量的NaOH溶液反应,消耗1molNaOH,则该有机物与足量的浓溴水反应的化学方程式为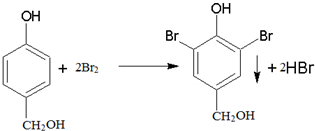 .
.
分析 有机物A是芳香烃的含氧衍生物,其相对分子质量不超过130,A中含氧的质量为25.8%,可以判断B中含有氧原子数:130×25.8%÷16=2.1,所以A中含有1个氧原子,A的相对分子质量为32÷25.8%=124,(124-32)÷12=7…8,所以A的分子式为C7H8O2,
解答 解:有机物A是芳香烃的含氧衍生物,其相对分子质量不超过130,A中含氧的质量为25.8%,可以判断B中含有氧原子数:130×25.8%÷16=2.1,所以A中含有1个氧原子,A的相对分子质量为32÷25.8%=124,(124-32)÷12=7…8,所以A的分子式为C7H8O2,A苯环上的一氯代物有两种,A为 ,A有4种同分异构体
,A有4种同分异构体 、
、 、
、
 ,A与足量的浓溴水反应的化学方程式为:
,A与足量的浓溴水反应的化学方程式为: ,故答案为:C7H8O2;4;
,故答案为:C7H8O2;4; .
.
点评 本题考查有机物推断,综合分析确定A的结构是关键,做题时注意把利用好题给信息,采用正逆推相结合的方法推断,注意同分异构体的判断方法,为学习难点.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案
相关题目
10.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是( )
| A. | NH4H中 H+的核外电子排布与He相同 | |
| B. | NH4H溶于水,所形成的溶液显碱性 | |
| C. | NH4H固体投入少量的水中,有两种气体产生 | |
| D. | NH4H与水反应时,NH4H是氧化剂 |
5.某温度下,按照下表数据进行浓度对化学反应速率的影响的实验:
(已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)
请回答:
(1)②中加3% Na2S2O3溶液4 mL.
(2)测得中出现浑浊的时间可能是c(填字母). a.42s b.30s c.16s
(3)上述实验结论是对于一个化学反应,在其他条件不变时,反应物的浓度越大,化学反应速率越大.
(已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)
| 试管编号 | 3% Na2S2O3溶液 | H2O | 稀H2SO4(体积比为1:5) | 出现浑浊时间 |
| ① | 3mL | 3mL | 5滴 | 33s |
| ② | 4mL | 2mL | 5滴 | 28s |
| ③ | 5mL | 1mL | 5滴 | cs |
(1)②中加3% Na2S2O3溶液4 mL.
(2)测得中出现浑浊的时间可能是c(填字母). a.42s b.30s c.16s
(3)上述实验结论是对于一个化学反应,在其他条件不变时,反应物的浓度越大,化学反应速率越大.
6.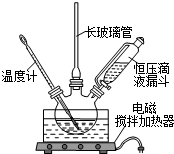 硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:
硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:
①
②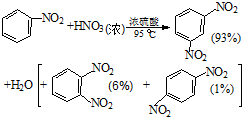
组装如图反应装置.有关数据列表如右下表:
制备硝基苯流程如下: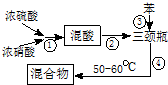
请回答:
(1)步骤①配制混酸:取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,操作是:在烧杯中先加入10mL浓硝酸,再沿烧杯壁注入20mL浓硫酸,并不断搅拌、冷却;把配好的混和酸加入恒压漏斗中;最后在三颈烧瓶中加入18mL苯.
(2)在室温下向三颈瓶中的苯逐滴加入混酸,边滴边搅拌,混和均匀、加热.实验装置中长玻璃管最好用球形冷凝管代替(填仪器名称);上图中的加热方式称为水浴加热;反应温度控制在50~60℃的原因是防止副反应反应.
硝基苯的提纯步骤为:

(3)步骤⑤表明混合物中有苯和硝基苯的操作和现象是混合物倒入蒸馏水中,液体分为三层.
(4)验证步骤⑥中液体已洗净的操作和现象是:取最后一次洗涤液,向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;为了得到更纯净的硝基苯,还须先向液体中加入无水CaCl2除去水,然后蒸馏(填操作名称).
(5)设计实验证明中:“粗产品中2”中含二硝基苯测定粗产品的密度大于1.205g•cm-3.
(6)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O.
 硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:
硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:①

②

组装如图反应装置.有关数据列表如右下表:
| 物质 | 熔点/ ℃ | 沸点 /℃ | 密度(20℃) /g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶 |

请回答:
(1)步骤①配制混酸:取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,操作是:在烧杯中先加入10mL浓硝酸,再沿烧杯壁注入20mL浓硫酸,并不断搅拌、冷却;把配好的混和酸加入恒压漏斗中;最后在三颈烧瓶中加入18mL苯.
(2)在室温下向三颈瓶中的苯逐滴加入混酸,边滴边搅拌,混和均匀、加热.实验装置中长玻璃管最好用球形冷凝管代替(填仪器名称);上图中的加热方式称为水浴加热;反应温度控制在50~60℃的原因是防止副反应反应.
硝基苯的提纯步骤为:

(3)步骤⑤表明混合物中有苯和硝基苯的操作和现象是混合物倒入蒸馏水中,液体分为三层.
(4)验证步骤⑥中液体已洗净的操作和现象是:取最后一次洗涤液,向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;为了得到更纯净的硝基苯,还须先向液体中加入无水CaCl2除去水,然后蒸馏(填操作名称).
(5)设计实验证明中:“粗产品中2”中含二硝基苯测定粗产品的密度大于1.205g•cm-3.
(6)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O.
3.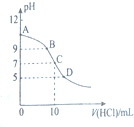 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | B、D两点溶液中水电离出来的c(OH-):B<0 | |
| D. | C点溶液中的H2O不发生电离 |