题目内容
15.A、B、C三种常见的短周期元素可以形成AB2、C2B、AB3、C2B2、B2等物质.已知B离子和C离子有相同的电子层结构,A离子比B离子多一个电子层,请回答:(1)A元素的名称是硫,
(2)用电子式表示C2B的形成过程
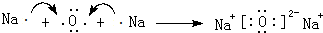 .
.(3)AB3在标准状况下为固态,AB3的水化物在低温下跟C2B2反应生成一种稳定性较差的过氧化物,该反应的化学方程式是H2SO4+Na2O2=Na2SO4+H2O2.
(4)AB3的水化物溶液跟C2A溶液反应的离子方程式是2H++S2-=H2S↑,此生应物之一跟AB2反应的化学方程式是2H2S+SO2=3S↓+2H2O.
(5)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和C2B的水溶液可形成氢氧燃料电池,负极的电极反应为2H2+4OH--4e-═4H2O,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8L饮用水时,电池内转移的电子数为200 NA.该电池在放电过程中,正极附近电解质溶液的pH将增大(填“增大”、“减小”或“不变”).电解质溶液里的OH-离子的移动方向是向负极移动(填正或负).
分析 B离子和C离子有相同的电子层结构,二者可以形成C2B,说明B是第二周期元素,C是第三周期元素,所以B是O,C是Na;由于A离子比B离子多一个电子层,且可以形成AB2、AB3,所以A是S元素.
(5)H2、O2和NaOH溶液形成氢氧燃料电池,负极发生氧化反应,氢气再负极失去电子,碱性条件下生成水,本质是氢气燃烧生成水,根据H元素化合价变化计算转移电子,该电池在放电过程中,正极是氧气获得电子,碱性条件下生成氢氧根离子,原电池中电解质溶液里的阴离子向负极移动,阳离子向正极•
解答 解:B离子和C离子有相同的电子层结构,二者可以形成C2B,说明B是第二周期元素,C是第三周期元素,所以B是O,C是Na;由于A离子比B离子多一个电子层,且可以形成AB2、AB3,所以A是S元素.
(1)由上述分析可知,A为硫元素,故答案为:硫;
(2)用电子式表示Na2O的形成过程为: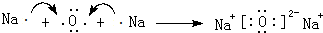 ,
,
故答案为: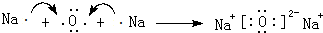 ;
;
(3)SO3熔点是16.8℃,沸点是44.8℃,标况下为固态,SO3的水化物为硫酸,在低温下跟Na2O2反应生成一种稳定性较差的过氧化物,该过氧化物为过氧化物,该反应的化学方程式是H2SO4+Na2O2=Na2SO4+H2O2,
故答案为:固;H2SO4+Na2O2=Na2SO4+H2O2;
(4)SO3的水化物溶液为硫酸,跟Na2S溶液反应的离子方程式是:2H++S2-=H2S↑,此反应物之一跟SO2反应的化学方程式是:2H2S+SO2=3S↓+2H2O,
故答案为:2H++S2-=H2S↑;2H2S+SO2=3S↓+2H2O;
(5)Na2O的水溶液为NaOH溶液,H2、O2和NaOH溶液形成氢氧燃料电池,负极发生氧化反应,氢气再负极失去电子,碱性条件下生成水,负极的电极反应为:2H2+4OH--4e-═4H2O,电极反应产生的水经冷凝后可作为航天员的饮用水,得到1.8L饮用水的物质的量为$\frac{1.8L×1000g/L}{18g/L}$=100mol,转移电子为200mol,则电池内转移的电子数为200 NA,该电池在放电过程中,正极是氧气获得电子,碱性条件下生成氢氧根离子,正极附近电解质溶液的pH将增大,电解质溶液里的OH-离子的移动方向是向负极移动,
故答案为:2H2+4OH--4e-═4H2O;200 NA;增大;负.
点评 本题考查元素周期表的结构以及元素周期律的应用,是高考中的常见题型,属于中等难度,解题的关键是掌握第1~18号元素名称和符号,元素同期表的结构,能根据元素同期律进行分析推断,有利于考查学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力.

 学业测评一课一测系列答案
学业测评一课一测系列答案(已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)
| 试管编号 | 3% Na2S2O3溶液 | H2O | 稀H2SO4(体积比为1:5) | 出现浑浊时间 |
| ① | 3mL | 3mL | 5滴 | 33s |
| ② | 4mL | 2mL | 5滴 | 28s |
| ③ | 5mL | 1mL | 5滴 | cs |
(1)②中加3% Na2S2O3溶液4 mL.
(2)测得中出现浑浊的时间可能是c(填字母). a.42s b.30s c.16s
(3)上述实验结论是对于一个化学反应,在其他条件不变时,反应物的浓度越大,化学反应速率越大.
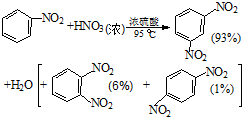
 硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:
硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:①

②
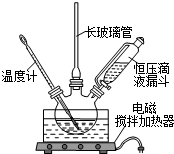
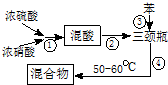
组装如图反应装置.有关数据列表如右下表:
| 物质 | 熔点/ ℃ | 沸点 /℃ | 密度(20℃) /g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶 |
请回答:
(1)步骤①配制混酸:取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,操作是:在烧杯中先加入10mL浓硝酸,再沿烧杯壁注入20mL浓硫酸,并不断搅拌、冷却;把配好的混和酸加入恒压漏斗中;最后在三颈烧瓶中加入18mL苯.
(2)在室温下向三颈瓶中的苯逐滴加入混酸,边滴边搅拌,混和均匀、加热.实验装置中长玻璃管最好用球形冷凝管代替(填仪器名称);上图中的加热方式称为水浴加热;反应温度控制在50~60℃的原因是防止副反应反应.
硝基苯的提纯步骤为:

(3)步骤⑤表明混合物中有苯和硝基苯的操作和现象是混合物倒入蒸馏水中,液体分为三层.
(4)验证步骤⑥中液体已洗净的操作和现象是:取最后一次洗涤液,向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;为了得到更纯净的硝基苯,还须先向液体中加入无水CaCl2除去水,然后蒸馏(填操作名称).
(5)设计实验证明中:“粗产品中2”中含二硝基苯测定粗产品的密度大于1.205g•cm-3.
(6)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O.
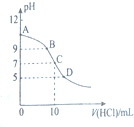 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | B、D两点溶液中水电离出来的c(OH-):B<0 | |
| D. | C点溶液中的H2O不发生电离 |
| A. | K层是能量最低的电子层 | |
| B. | 原子失电子时先失去能量低的电子 | |
| C. | 核外电子总是优先排布在能量较低的电子层上 | |
| D. | N层为次外层时,最多可容纳的电子数为18 |
| A. | v(O2)=0.001mol•L-1•s-1 | B. | v(NO)=0.0015 mol•L-1•s-1 | ||
| C. | v(H20)=0.003 mol•L-1•s-1 | D. | v(NH3)=0.001 mol•L-1•s-1 |
| A. | CH3Cl | B. | CH2Cl | C. | CHCl3 | D. | HCl |
 配合物种类繁多,应用广泛.按要求完成下列各题:
配合物种类繁多,应用广泛.按要求完成下列各题: