题目内容
5.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 常温常压下,2.8gCO与N2混合气体中含有的原子总数为0.2NA | |
| B. | 标准状况下,2.24L乙烷含有分子的数目为0.1NA | |
| C. | 1L1mol•L-1的CuCl2溶液中含有Cu2+的数目为NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
分析 A、CO和氮气的摩尔质量均为28g/mol,且均为双原子分子;
B、分子个数N=$\frac{V}{Vm}{N}_{A}$;
C、铜离子为弱碱阳离子,在溶液中会水解;
D、过氧化钠与氧气反应时,氧元素的价态由-1价变为0价.
解答 解:A、CO和氮气的摩尔质量均为28g/mol,故2.8g混合物的物质的量为0.1mol,且两者均为双原子分子,故0.1mol混合物中含0.2NA个原子,故A正确;
B、分子个数N=$\frac{V}{Vm}{N}_{A}$=$\frac{2.24L}{22.4L/mol}{N}_{A}/mol$=0.1NA个,故B正确;
C、铜离子为弱碱阳离子,在溶液中会水解,故溶液中的铜离子的个数小于NA个,故C错误;
D、过氧化钠与氧气反应时,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时,转移0.2NA个电子,故D错误.
故选AB.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素教案的内在联系,成为化学史上的重要里程碑之一.下列有关元素周期表的说法正确的是( )
| A. | 第ⅠA族的元素全部是金属元素 | |
| B. | 元素周期表有18个纵行,即18个族 | |
| C. | 短周期是第一、二、三、四周期 | |
| D. | 元素周期表有七个横行,也是七个周期 |
16.下列物质的鉴别和分离方法正确的是( )
| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用加热法分离NH4Cl和I2 | |
| C. | 用无水乙醇提取碘水中的单质碘 | |
| D. | 用饱和Na2CO3溶液鉴别乙酸和乙酸乙酯 |
13.下列溶液中微粒浓度关系正确的是( )
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=5的NH4Cl溶液与pH=5的硫酸中,水电离的c(H+)相同 | |
| C. | pH=9的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) |
20.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-$→_{转换}^{H+}$Cr2O72-$→_{还原}^{Fe_{2}+}$Cr3+$→_{沉淀}^{OH-}$Cr(OH)3↓
己知转化过程中的反应为:2CrO42-(aq)+2H+(aq)═Cr2O72-(aq)+H2O(1).转化后所得溶液中铬元素含量为28.6g/L,CrO42-有10/11转化为Cr2O72-.下列说法不正确的是( )
CrO42-$→_{转换}^{H+}$Cr2O72-$→_{还原}^{Fe_{2}+}$Cr3+$→_{沉淀}^{OH-}$Cr(OH)3↓
己知转化过程中的反应为:2CrO42-(aq)+2H+(aq)═Cr2O72-(aq)+H2O(1).转化后所得溶液中铬元素含量为28.6g/L,CrO42-有10/11转化为Cr2O72-.下列说法不正确的是( )
| A. | 转化过程中,增大c(H+),平衡向正反应方向移动,CrO42-的转化率提高 | |
| B. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 | |
| C. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g | |
| D. | 常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |
17.既发生了化学反应,又有电解质的溶解过程,且这两个过程都吸热的是( )
| A. | 冰醋酸与NaOH溶液反应 | B. | KNO3加入水中 | ||
| C. | NH4NO3加入水中 | D. | CaO加入水中 |

 .
. .
. 的合成路线(无机原料任选).(合成路线的常用表示方法为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$目标产物).
的合成路线(无机原料任选).(合成路线的常用表示方法为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$目标产物).
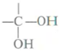 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$
 .
.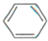 +
+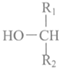 $\stackrel{酶}{→}$
$\stackrel{酶}{→}$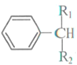 +H2O则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式
+H2O则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式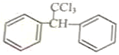 .
.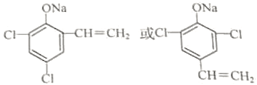 (任写一种)
(任写一种)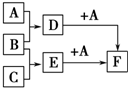 已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.
已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.