题目内容
17.既发生了化学反应,又有电解质的溶解过程,且这两个过程都吸热的是( )| A. | 冰醋酸与NaOH溶液反应 | B. | KNO3加入水中 | ||
| C. | NH4NO3加入水中 | D. | CaO加入水中 |
分析 A、冰醋酸和氢氧化钠溶液的反应为酸碱中和;
B、硝酸钾加入水中没有化学反应发生;
C、硝酸铵加入水中后,先溶于水,然后发生盐类的水解;
D、氧化钙放入水中后和水发生化合反应.
解答 解:A、冰醋酸和氢氧化钠溶液的反应为酸碱中和,而酸碱中和为放热反应,故A错误;
B、由于硝酸钾为强酸强碱盐,不能水解,故硝酸钾加入水中没有化学反应发生,故不符合题干的要求,故B错误;
C、硝酸铵加入水中后,先溶于水,而铵盐溶于水为吸热的物理过程;然后发生盐类的水解,由于盐类的水解为酸碱中和的逆反应,故盐类水解吸热,故C正确;
D、氧化钙放入水中后和水发生化合反应,为放热反应,故D错误.
故选C.
点评 本题考查了常见的吸放热反应和吸放热的物理过程,难度不大,注意基础的掌握.

练习册系列答案
相关题目
7.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 4℃时,18g 21H2168O中含有电子数为10NA | |
| B. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| C. | 常温下,1L0.1mol•L-1的NH4NO3溶液中所含氮原子数为0.2 NA | |
| D. | 标准状况下,22.4 L的CCl4中C-Cl键数为4NA |
5.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,2.8gCO与N2混合气体中含有的原子总数为0.2NA | |
| B. | 标准状况下,2.24L乙烷含有分子的数目为0.1NA | |
| C. | 1L1mol•L-1的CuCl2溶液中含有Cu2+的数目为NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
12.下列有关14C60的叙述正确的是( )
| A. | 与12C60化学性质相同 | B. | 与12C60互为同素异形体 | ||
| C. | 属于原子晶体 | D. | 与12C60互为同位素 |
2.用下列①②对应的试剂(或条件)不能达到实验目的是( )
| 实验目的 | 试剂(或条件) | ||
| A | 用温度的变化鉴别二氧化氮和溴蒸气 | ①热水浴 | ②冷水浴 |
| B | 用Na块检验乙醇分子中存在不同于烃分子里的氢原子 | ①乙醇 | ②己烷 |
| C | 用不同的有色物质比较二氧化硫和氯水漂白性的差异 | ①石蕊 | ②品红 |
| D | 用溴水检验苯的同系物中烷基对苯环有影响 | ①苯 | ②甲苯 |
| A. | A | B. | B | C. | C | D. | D |
9.甲、乙、丙、丁、戊均为短周期主族元素,甲的原子半径是第二周期中最小的;乙的单质能跟冷水剧烈反应产生氢气;丙原子核外p电子比s电子多5个;丁和丙在同周期,丁的最高价为+4价;戊的单质是气体,其密度介于H2和O2的密度之间.下列推断错误的是( )
| A. | 甲的非金属性最强 | |
| B. | 戊的最高价氧化物的水化物酸性最强 | |
| C. | 原子半径大小为:乙>丙>甲 | |
| D. | 乙分别与甲、丙形成晶体M、N的熔点大小为:M<N |
6.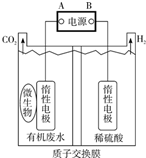 在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )
在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )
 在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )
在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )| A. | 电极A为负极 | |
| B. | 电解中生成的CO2与H2物质的量之比为1:1 | |
| C. | 阳极反应为:CH3COOH一8e-+8OH-═2CO2↑+6H2O | |
| D. | 电解前后,阴极室的pH几乎保持不变 |
7.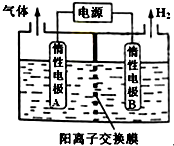 利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )
利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )
 利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )
利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )| A. | B极区电解质溶液为LiOH溶液 | |
| B. | 阳极电极反应式为2Cl--2e-═Cl2↑ | |
| C. | 电解过程中主要是H+通过阳离子交换膜向B电极迁移 | |
| D. | 电极A连接电源的正极 |
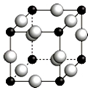 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):