题目内容
如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )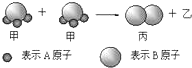

| A、根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子 |
| B、该反应类型是分解反应 |
| C、该反应一定属于氧化还原反应 |
| D、Mr(甲)=Mr(乙)+Mr(丙) |
考点:球棍模型与比例模型,化学基本反应类型
专题:化学用语专题
分析:由图示可以推出甲、丙的化学式可分别表示为A3B、B2.根据质量守恒定律化学反应前后原子的个数不变,可知3个乙分子中共含有6个A原子,则乙为单质,化学式可表示为A2,该反应可以表示为2BA3→B2+3A2,化学反应过程中原子种类不发生变化,以此解答该题.
解答:
解:A.根据质量守恒定律,化学变化前后原子种类、数目不变,反应前反应物的2个分子中共有6个A原子、2个B原子,而反应后生成物丙的1个分子中含2个B原子,则生成物乙的3个分子中应含6个A原子,则每个乙分子中含2个A原子,本题与阿伏伽德罗定律无关,故A错误;
B.反应的特点是化合物生成单质,该反应可以表示为2BA3→B2+3A2,为分解反应,故B正确;
C.该反应为分解反应,且有单质生成,A元素化合价一定变化,属于氧化还原反应,故C正确;
D.该反应可以表示为2BA3→B2+3A2,则2Mr(甲)=3Mr(乙)+Mr(丙),故D错误;
故选AD.
B.反应的特点是化合物生成单质,该反应可以表示为2BA3→B2+3A2,为分解反应,故B正确;
C.该反应为分解反应,且有单质生成,A元素化合价一定变化,属于氧化还原反应,故C正确;
D.该反应可以表示为2BA3→B2+3A2,则2Mr(甲)=3Mr(乙)+Mr(丙),故D错误;
故选AD.
点评:本题属于微观示意图的考查,解题的关键是能够根据微观的分子结构分析物质的组成,然后结合相关的知识逐项分析;注意质量守恒定律和阿伏加德罗定律的区别.

练习册系列答案
相关题目
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、MnO4-、CO32-、 |
| B、c(H+)=1×10-13 mol?L-1的溶液中:Mg2+、Cu2+、NO3- |
| C、0.1 mol?L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| D、0.1 mol?L-1FeCl3溶液中:Fe2+、SCN-、SO42- |
下列各组物质中,均为纯净物的一组是( )
| A、碘酒 干冰 |
| B、液氯 浓硫酸 |
| C、石灰石 氨水 |
| D、CuSO4?5H2O 冰水混合物 |
下列离子方程式正确的是( )
| A、Na2CO3 溶液中滴入少量盐酸:CO32-+H+═HCO3- |
| B、钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、Ba(OH)2与稀H2SO4反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
| D、FeCl3溶液与Cu反应:Cu+Fe3+=Cu2++Fe2+ |
下列说法中正确的是(NA表示阿伏加德罗常数)( )
| A、40g SO2气体所占的体积为11.2L |
| B、7.1gCl2与足量水反应转移电子数为0.1NA |
| C、1mol?L-1的CH3COONa溶液中,CH3COO-离子数小于NA |
| D、常温常压下,32gO2和O3的混合气体含氧原子数为2NA |
美国《时代周刊》将氢燃料电池评为21世纪对人类生活具有重大影响的技术之一.培根电池是一种碱性的氢氧燃料电池,已经应用在“阿波罗六号”太空船上.将多个培根电池组合为电池组,向外供电,电池组工作稳定后,它的电动势和内阻基本保持不变.电池所产生的水可以作为饮用水,今欲得常温下水1L,则电池内电子转移的物质的量约为( )
| A、8.9×10-3mol |
| B、4.5×10-2mol |
| C、1.1×102mol |
| D、5.6×10mol |