题目内容
下列说法中正确的是(NA表示阿伏加德罗常数)( )
| A、40g SO2气体所占的体积为11.2L |
| B、7.1gCl2与足量水反应转移电子数为0.1NA |
| C、1mol?L-1的CH3COONa溶液中,CH3COO-离子数小于NA |
| D、常温常压下,32gO2和O3的混合气体含氧原子数为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.没有告诉在标况下,不能使用标况下的气体摩尔体积计算二氧化硫的体积;
B.氯气与水的反应中,只有部分氯气与水反应生成氯化氢和次氯酸;
C.缺少醋酸钠溶液的体积,无法计算溶液中醋酸根离子的数目;
D.氧气和臭氧中都只含有氧原子,32g混合物中含有32g氧原子,含有2mol氧原子.
B.氯气与水的反应中,只有部分氯气与水反应生成氯化氢和次氯酸;
C.缺少醋酸钠溶液的体积,无法计算溶液中醋酸根离子的数目;
D.氧气和臭氧中都只含有氧原子,32g混合物中含有32g氧原子,含有2mol氧原子.
解答:
解:A.40g二氧化硫的物质的量为0.5mol,不是标准状况下,不能使用标况下的气体摩尔体积计算二氧化硫的体积,故A错误;
B.7.1g氯气的物质的量为0.1mol,0.1mol氯气与水反应,只有部分氯气与水反应生成氯化氢和次氯酸,反应转移的电子小于0.1mol,反应转移电子数小于0.1NA,故B错误;
C.没有告诉醋酸钠溶液的体积,无法计算溶液中醋酸根离子的数目,故C错误;
D.32g混合物中含有32g氧原子,含有氧原子的物质的量为2mol,混合气体含氧原子数为2NA,故D正确;
故选D.
B.7.1g氯气的物质的量为0.1mol,0.1mol氯气与水反应,只有部分氯气与水反应生成氯化氢和次氯酸,反应转移的电子小于0.1mol,反应转移电子数小于0.1NA,故B错误;
C.没有告诉醋酸钠溶液的体积,无法计算溶液中醋酸根离子的数目,故C错误;
D.32g混合物中含有32g氧原子,含有氧原子的物质的量为2mol,混合气体含氧原子数为2NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项C为易错点,注意题中缺少溶液的体积.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
下列各组为两种元素的原子序数,其中不能反应生成AB3型化合物的是( )
| A、13和17 | B、16和8 |
| C、9和11 | D、7和1 |
区别硫酸铜溶液和氢氧化铁胶体最简单的方法是( )
| A、观察溶液颜色 | B、丁达尔效应 |
| C、过滤 | D、加热 |
如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )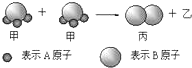

| A、根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子 |
| B、该反应类型是分解反应 |
| C、该反应一定属于氧化还原反应 |
| D、Mr(甲)=Mr(乙)+Mr(丙) |
下列离子方程式书写正确的是( )
| A、钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、碳酸钠溶液显碱性:CO32-+2H2O═H2CO3+2OH- |
| C、Na2O2溶于水:Na2O2+H2O═2Na++2OH-+O2↑ |
| D、碳酸氢钠溶液中滴入氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A、氢氧化钠与盐酸;氢氧化铜与盐酸 |
| B、石灰石与硝酸反应;石灰石与盐酸反应 |
| C、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| D、Na2CO3溶液与硝酸溶液;CaCO3与硝酸溶液 |
下列说法正确的是( )
| A、Na和NaCl灼烧时,它们的焰色反应分别是黄色和无色 |
| B、在2Al+2H2O+2NaOH=2NaAlO2+3H2#中,氧化剂是H2O和NaOH |
| C、H2和Cl2只有在点燃条件下才可以反应 |
| D、在标准状况下,1 mol H2和O2混合气体,所占的体积约是22.4 L |
 (1)表中A的数值为
(1)表中A的数值为