题目内容
(1)在标准状况下,67.2LCO2是 mol,质量为 g,含有 个CO2分子,其中含有 mol氧原子.
(2)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是 ;A的相对原子质量是 ;ACl2的化学式是
(3)同温同压下的氧气和氢气,其密度比为 ;若质量相同时,两种气体的体积比为 _;若体积相同时,两种气体的质量比为 .
(4)用40克NaOH配制成250毫升溶液,其物质的量浓度是 ,取出5毫升这种溶液,它的物质的量浓度为 ,把取出的5毫升溶液加水至100毫升,则物质的量浓度是 ,其中含 克NaOH.
(2)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是
(3)同温同压下的氧气和氢气,其密度比为
(4)用40克NaOH配制成250毫升溶液,其物质的量浓度是
考点:物质的量的相关计算
专题:计算题
分析:(1)n=
=
=
结合分子的构成计算.
(2)根据公式M=
来确定分子的摩尔质量,最后根据相对分子质量的大小确定金属元素的相对原子质量及ACl2的化学式.
(3)同温同压下,根据ρ=
计算其密度之比;根据n=
=
计算体积之比、质量之比;
(4)根据c=
计算物质的量难度;根据n=cV计算取出10mL溶液中氢氧化钠的物质的量,再根据m=nM计算氢氧化钠的质量,根据c=
计算稀释后溶液物质的量浓度.
| V |
| Vm |
| m |
| M |
| N |
| NA |
(2)根据公式M=
| m |
| n |
(3)同温同压下,根据ρ=
| M |
| Vm |
| V |
| Vm |
| m |
| M |
(4)根据c=
| n |
| V |
| n |
| V |
解答:
解:(1)n(CO2)=
=3mol,m(CO2)=3mol×44g/mol=132g,N(CO2)=3mol×NA/mol=3NA,n(O)=2n(CO2)=6mol,
故答案为:3;132;3NA;6.
(2)因氯化物ACl2中含有0.4molCl-可知,氯化物ACl2的物质的量为
=0.2mol,则M(ACl2)=
=95g/mol,所以ACl2相对分子质量为95,A的相对原子量为95-71=24,A为镁元素,ACl2的化学式MgCl2;
故答案为:95g/mol;24;MgCl2;
(3)同温同压下,气体摩尔体积相等,根据ρ=
知其密度之比等于其摩尔质量之比,所以其密度之比=32g/mol:2g/mol=16:1;
质量相等时,根据n=
=
知体积之比为摩尔质量的反比,所以气体的体积比为2g/mol:32g/mol=1:16;
体积相等时,根据n=
=
知质量之比为摩尔质量之比,所以质量之比为22g/mol:2g/mol=16:1;
故答案为:16:1;1:16;16:1;
(4)40g NaOH的物质的量为
=1mol,溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为
=4mol/L,溶液是均匀的,取出5mL溶液的浓度与原溶液浓度相等,取出5mL溶液中NaOH的物质的量=0.005L×4mol/L=0.02mol,5mL溶液中氢氧化钠的质量=0.02mol×40g/mol=0.8g,将该5mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为
=0.2mol/L.
故答案为;4mol/L;4mol/L;0.2mol/L;0.8.
| 67.2L |
| 22.4L/mol |
故答案为:3;132;3NA;6.
(2)因氯化物ACl2中含有0.4molCl-可知,氯化物ACl2的物质的量为
| 0.4mol |
| 2 |
| 19g |
| 0.2mol |
故答案为:95g/mol;24;MgCl2;
(3)同温同压下,气体摩尔体积相等,根据ρ=
| M |
| Vm |
质量相等时,根据n=
| V |
| Vm |
| m |
| M |
体积相等时,根据n=
| V |
| Vm |
| m |
| M |
故答案为:16:1;1:16;16:1;
(4)40g NaOH的物质的量为
| 40g |
| 40g/mol |
| 1mol |
| 0.25L |
| 0.02mol |
| 0.1L |
故答案为;4mol/L;4mol/L;0.2mol/L;0.8.
点评:本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式和分子构成,难度不大.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
下列元素中按非金属性逐渐减弱的顺序排列的是( )
| A、Na、Mg、Al |
| B、C、N、O |
| C、Cl、P、S |
| D、O、S、Se |
区别硫酸铜溶液和氢氧化铁胶体最简单的方法是( )
| A、观察溶液颜色 | B、丁达尔效应 |
| C、过滤 | D、加热 |
如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )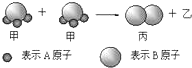

| A、根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子 |
| B、该反应类型是分解反应 |
| C、该反应一定属于氧化还原反应 |
| D、Mr(甲)=Mr(乙)+Mr(丙) |
下列离子方程式书写正确的是( )
| A、钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、碳酸钠溶液显碱性:CO32-+2H2O═H2CO3+2OH- |
| C、Na2O2溶于水:Na2O2+H2O═2Na++2OH-+O2↑ |
| D、碳酸氢钠溶液中滴入氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
下列情况可能引起水污染的是( )
①农业生产农药、化肥使用不当;②海上油轮原油的泄漏;
③工业生产中废气、废液、废渣排放;④生活垃圾的任意堆放.
①农业生产农药、化肥使用不当;②海上油轮原油的泄漏;
③工业生产中废气、废液、废渣排放;④生活垃圾的任意堆放.
| A、只有①② | B、只有②③ |
| C、①②③ | D、①②③④ |