题目内容
下列离子方程式正确的是( )
| A、Na2CO3 溶液中滴入少量盐酸:CO32-+H+═HCO3- |
| B、钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、Ba(OH)2与稀H2SO4反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
| D、FeCl3溶液与Cu反应:Cu+Fe3+=Cu2++Fe2+ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.少量盐酸反应生成碳酸氢钠和NaCl;
B.电子、电荷不守恒;
C.不符合离子的配比;
D.电子、电荷不守恒.
B.电子、电荷不守恒;
C.不符合离子的配比;
D.电子、电荷不守恒.
解答:
解:A.Na2CO3 溶液中滴入少量盐酸的离子反应为CO32-+H+═HCO3-,故A正确;
B.钠与水反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.Ba(OH)2与稀H2SO4反应的离子反应为Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故C错误;
D.FeCl3溶液与Cu反应的离子反应为Cu+2Fe3+=Cu2++2Fe2+,故D错误;
故选A.
B.钠与水反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.Ba(OH)2与稀H2SO4反应的离子反应为Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故C错误;
D.FeCl3溶液与Cu反应的离子反应为Cu+2Fe3+=Cu2++2Fe2+,故D错误;
故选A.
点评:本题考查离子反应方程式书写的正误判断,为高考常见题型,侧重氧化还原反应、复分解反应的离子反应考查,注意电子、电荷守恒,注重化学用语的夯实训练,题目难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
下列说法正确的是( )
| A、非自发进行的反应一定不能发生 |
| B、自发进行的反应一定能迅速发生 |
| C、在一定条件下,非自发进行的反应也能发生 |
| D、吸热反应一定不能自发进行 |
据报道,美国科学家制得一种新原子,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是( )
| A、这种原子的中子数为167 |
| B、它位于元素周期表中第六周期 |
| C、这种元素一定是金属元素 |
| D、这种元素的原子易与氢化合 |
下列物质中所含原子数与0.1mol H3PO4所含原子数相等的是( )
| A、0.4 mol H2O |
| B、0.2 mol H2SO4 |
| C、0.4 mol HCl |
| D、0.3 mol HNO3 |
如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )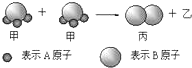

| A、根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子 |
| B、该反应类型是分解反应 |
| C、该反应一定属于氧化还原反应 |
| D、Mr(甲)=Mr(乙)+Mr(丙) |
能正确表示下列反应的离子方程式是( )
| A、用过量氨水吸收工业尾气中的SO2:2NH3?H20+SO2═2NH4++SO32-+H2O |
| B、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| C、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
| D、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A、氢氧化钠与盐酸;氢氧化铜与盐酸 |
| B、石灰石与硝酸反应;石灰石与盐酸反应 |
| C、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| D、Na2CO3溶液与硝酸溶液;CaCO3与硝酸溶液 |
 无机化合物可根据其组成和性质进行分类,以Na、H、O、N中任两种或三种元素组成合适的物质,分别填在下表②③的后面.
无机化合物可根据其组成和性质进行分类,以Na、H、O、N中任两种或三种元素组成合适的物质,分别填在下表②③的后面.