题目内容
根据已学知识,回答下列问题:
(1)具有(n-1)d10n s2电子构型的元素位于周期表中 区和 族.
(2)写出3P轨道上有2个未成对电子的元素名称: .
(3)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素X,该元素的价电子排布式为3d54s1,该元素可与氧元素形成离子X2O72-,K2X2O7氧化浓盐酸生成氯气的同时还生成了X3+,写出该反应的离子方程式 .
(4)键能是指气态基态原子形成1mol化学键释放的最低能量.某些化学键的键能如表格所示(单位:kJ?mol-1):
①由表中所列化学键形成的单质分子中,最不稳定的是 .
②通过表中键能数据,计算说明N2分子中的 键比 键稳定(填
“σ”或“π”).
③化学反应的实质是旧化学键断裂和新化学键形成的过程.现有化学反应方程式P4(s)+3O2(g)=P4O6(s),通过计算可以确定,1molP4(s)参加该反应, (填“吸收”或“放出”)的热量为 kJ.
(1)具有(n-1)d10n s2电子构型的元素位于周期表中
(2)写出3P轨道上有2个未成对电子的元素名称:
(3)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素X,该元素的价电子排布式为3d54s1,该元素可与氧元素形成离子X2O72-,K2X2O7氧化浓盐酸生成氯气的同时还生成了X3+,写出该反应的离子方程式
(4)键能是指气态基态原子形成1mol化学键释放的最低能量.某些化学键的键能如表格所示(单位:kJ?mol-1):
| 键 | H-H | N≡N | O=O | F-F | H-Cl |
| 键能 | 436 | 946 | 498 | 157 | 431 |
| 键 | N-N | P-P | P-O | Cl-Cl | Br-Br |
| 键能 | 193 | 198 | 360 | 242.7 | 193 |
②通过表中键能数据,计算说明N2分子中的
“σ”或“π”).
③化学反应的实质是旧化学键断裂和新化学键形成的过程.现有化学反应方程式P4(s)+3O2(g)=P4O6(s),通过计算可以确定,1molP4(s)参加该反应,
考点:元素周期表的结构及其应用,有关反应热的计算,原子核外电子排布,键能、键长、键角及其应用
专题:化学反应中的能量变化,元素周期律与元素周期表专题
分析:(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区;(n-1)d全充满,最后的电子填s轨道,为ds区元素;
(2)3P轨道上有2个未成对电子的木核外电子排布3P2和3P4 ,分别是硅和硫;
(3)价电子排布式为3d54s1,是铬元素,然后根据得失电子守恒,书写离子方程式;
(4)形成的单质分子化学键的键能越小越不稳定;
(5)N≡N中含有2个π键,1个σ键,已知N≡N键能为946kJ/mol,N-N单键键能为193kJ/mol,则1个π键的键能为
kJ/mol=376.5kJ/mol,以此判断;
(6)根据白磷燃烧放出的热量为生成物的键能减反应物的键能.
(2)3P轨道上有2个未成对电子的木核外电子排布3P2和3P4 ,分别是硅和硫;
(3)价电子排布式为3d54s1,是铬元素,然后根据得失电子守恒,书写离子方程式;
(4)形成的单质分子化学键的键能越小越不稳定;
(5)N≡N中含有2个π键,1个σ键,已知N≡N键能为946kJ/mol,N-N单键键能为193kJ/mol,则1个π键的键能为
| 946-193 |
| 2 |
(6)根据白磷燃烧放出的热量为生成物的键能减反应物的键能.
解答:
解:(1)最后填充s电子,为s区元素,包括ⅠA、ⅡA及He元素,最后填充p轨道电子,为p区元素,主要为主族和0族元素,最后填充d轨道电子,为d区元素,包括ⅢB~ⅤⅡB和ⅤⅢ族(锕系、镧系除外),为过渡元素,(n-1)d全充满,最后的电子填在s轨道上,为ds区元素,包括ⅠB、ⅡB元素,为过渡金属,(n-1)d10ns2电子构型的元素,(n-1)d全充满,最后2个电子填在s轨道上,为ds区元素,
故答案为:ds;ⅡB;
(2)3P轨道上有2个未成对电子的木核外电子排布3P2和3P4 ,分别是硅和硫,故答案为:硅、硫;
(3)价电子排布式为3d54s1,是铬元素,重铬酸根将浓盐酸中的负一价的氯氧化为氯气,此离子方程式反应为 Cr2O72-+14H++6Cl-=2Cr3++3Cl2 ↑+7H2O,故答案为:Cr2O72-+14H++6Cl-=2Cr3++3Cl2 ↑+7H2O;
(4)形成的单质分子化学键的键能越小越不稳定,F-F的键能最小,故答案为:F2;
(5)N≡N中含有2个π键,1个σ键,已知N≡N键能为946kJ/mol,N-N单键键能为193kJ/mol,则1个π键的键能为
kJ/mol=376.5kJ/mol,则N2中的π键键能大于σ键键能,较稳定,故答案为:π;σ;
(6)白磷燃烧放出的热量=生成物的键能-反应物的键能=12×360kJ-(6×198)kJ-(3×498)kJ=1638kJ,故答案为:放出;1638.
故答案为:ds;ⅡB;
(2)3P轨道上有2个未成对电子的木核外电子排布3P2和3P4 ,分别是硅和硫,故答案为:硅、硫;
(3)价电子排布式为3d54s1,是铬元素,重铬酸根将浓盐酸中的负一价的氯氧化为氯气,此离子方程式反应为 Cr2O72-+14H++6Cl-=2Cr3++3Cl2 ↑+7H2O,故答案为:Cr2O72-+14H++6Cl-=2Cr3++3Cl2 ↑+7H2O;
(4)形成的单质分子化学键的键能越小越不稳定,F-F的键能最小,故答案为:F2;
(5)N≡N中含有2个π键,1个σ键,已知N≡N键能为946kJ/mol,N-N单键键能为193kJ/mol,则1个π键的键能为
| 946-193 |
| 2 |
(6)白磷燃烧放出的热量=生成物的键能-反应物的键能=12×360kJ-(6×198)kJ-(3×498)kJ=1638kJ,故答案为:放出;1638.
点评:本题综合考查原子核外电子排布以及原子结构与元素周期表知识,侧重考查原子的电子排布及区的划分、杂化轨道、8电子结构的判断等,为高频考点,明确元素在周期表中的位置、元素所处主族、成键数是解本题关键,题目难度中等.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
以化学平衡与化学反应速率的关系可知( )
| A、化学反应速率变化时,化学平衡一定发生移动 |
| B、化学平衡发生移动时、化学反应速率一定变化 |
| C、正反应进行的程度大、正反应速率一定大 |
| D、只有使用催化剂才会发生化学反应速率变化,而化学平衡不移动的情况. |
下列各组为两种元素的原子序数,其中不能反应生成AB3型化合物的是( )
| A、13和17 | B、16和8 |
| C、9和11 | D、7和1 |
下列说法正确的是( )
| A、氢键、分子间作用力、离子键、共价键都是微粒间的作用力.其中分子间作用力只影响物质的熔沸点而不影响物质的溶解性 |
| B、石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 |
| C、结合质子能力由强到弱的顺序是OH->CH3COO->Cl- |
D、原子结构模型的演变经历了: |
下列元素中按非金属性逐渐减弱的顺序排列的是( )
| A、Na、Mg、Al |
| B、C、N、O |
| C、Cl、P、S |
| D、O、S、Se |
据报道,美国科学家制得一种新原子,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是( )
| A、这种原子的中子数为167 |
| B、它位于元素周期表中第六周期 |
| C、这种元素一定是金属元素 |
| D、这种元素的原子易与氢化合 |
区别硫酸铜溶液和氢氧化铁胶体最简单的方法是( )
| A、观察溶液颜色 | B、丁达尔效应 |
| C、过滤 | D、加热 |
如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )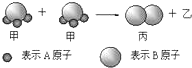

| A、根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子 |
| B、该反应类型是分解反应 |
| C、该反应一定属于氧化还原反应 |
| D、Mr(甲)=Mr(乙)+Mr(丙) |
下列说法正确的是( )
| A、Na和NaCl灼烧时,它们的焰色反应分别是黄色和无色 |
| B、在2Al+2H2O+2NaOH=2NaAlO2+3H2#中,氧化剂是H2O和NaOH |
| C、H2和Cl2只有在点燃条件下才可以反应 |
| D、在标准状况下,1 mol H2和O2混合气体,所占的体积约是22.4 L |