题目内容
16.下列各组离子在酸性溶液中能大量共存的是( )| A. | K+、Na+、HCO${\;}_{3}^{-}$、Cl- | B. | Fe3+、SCN-、Cl-、SO${\;}_{4}^{2-}$ | ||
| C. | NH${\;}_{4}^{+}$、Fe2+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | D. | Mg2+、Fe2+、SO${\;}_{4}^{2-}$、Cl- |
分析 酸性溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能结合生成络离子,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:酸性溶液中含大量的氢离子,
A.酸溶液中不能大量存在HCO3-,故A错误;
B.Fe3+、SCN-结合生成络离子,不能大量共存,故B错误;
C.酸溶液中Fe2+、NO3-发生氧化还原反应,不能大量共存,故C错误;
D.酸溶液中该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
13.下列事实中,一定能说明X、Y两种元素为同一主族的是( )
| A. | 原子半径X<Y | B. | 均有+3价 | ||
| C. | 最外层电子数均为5 | D. | 最外层均有2个电子 |
6.在恒温恒容的密闭容器中,有可逆反应2NO(g)+O2(g)?2NO2(g).下列能说明该反应已达到化学平衡状态的是( )
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | 反应容器中密度不随时间变化而变化 | |
| C. | 混合气体颜色深浅保持不变 | |
| D. | NO2、NO、O2的物质的量浓度之比为2:2:1 |
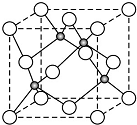 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题: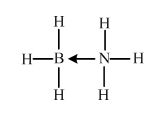 (必须标明配位键)
(必须标明配位键)
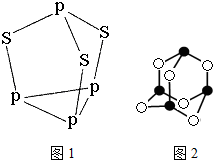 磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.
磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题. ;
;