题目内容
1. 磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.
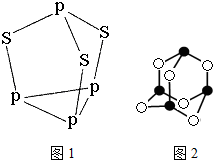
磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.(1)三硫化四磷是黄绿色针状结晶,其结构如图1所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.
①Se的简化电子排布式为[Ar]3d104s24p4;
②第一电离能:Se<As(填“>”“<”或“=”)
③三硫化四磷分子中P原子采取sp3杂化,与PO3-互为等电子体的化合物分子的化学式为SO3.
④用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为NA.
⑤纯叠氮酸(HN3)在常温下是一种液体,沸点较高,主要原因是HN3分子间存在氢键.
(2)“砒霜”是一种含砷氧化物,其分子结构如图2所示,该化合物的分子式为As4O6,砷原子采取sp3杂化.
分析 (1)①Se是S的下一周期同主族元素,其核外电子排布式为[Ar]3d104s24p4;
②同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第ⅤA族元素大于相邻元素;
③P4S3中P原子成3个P-S键、含有一对孤对电子;等电子体要原子总数相同,价电子总数相等;
④根据图知,每个P上1对孤对电子对,每个S有2对孤对电子对;
⑤HN3分子间存在氢键,使沸点反常的升高;
(2)该分子中,As原子个数为4、O原子个数为6,据此判断其分子式;根据价层电子对互斥理论确定As原子杂化方式.
解答 解:(1)①Se是S的下一周期同主族元素,其核外电子排布式为[Ar]3d104s24p4,故答案为:[Ar]3d104s24p4;
②同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第ⅤA族元素大于相邻元素;第一电离能:Se<As,故答案为:<;
③P4S3中P原子成3个P-S键、含有一对孤对电子,杂化轨道数为4,P原子采取sp3杂化;与PO3-互为等电子体的化合物分子的化学式为SO3;
故答案为:sp3;SO3;
④根据图知,每个P上1对孤对电子对,每个S有2对孤对电子对,1mol共10对孤对电子对,0.1mol含有NA孤对电子对数,故答案为:NA;
⑤纯叠氮酸(HN3)在常温下是一种液体,沸点较高,主要原因是HN3分子间存在氢键,使沸点反常的升高,故答案为:HN3分子间存在氢键;
(2)根据分子结构可知,分子内含有6个氧原子,4个砷原子,化学式为As4O6,每个As原子形成3个共价键,又因为中心原子还有1对孤对电子,所以采用的是sp3杂化,故答案为:As4O6;sp3.
点评 本题考查了核外电子排布式、杂化轨道类型、第一电离能、化学键判断等知识,注重原子结构和性质的考查,易错点是(2)分子式确定,综合性较强,难度较大.

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | 可以在空气中燃烧 | |
| B. | 与C12发生取代反应 | |
| C. | 可以与溴水中的溴反应而使溴水褪色 | |
| D. | 能使高锰酸钾溶液褪色 |
| A. | 365g 10%的盐酸 | B. | 22.4L 氯化氢 (已知密度为1.7g/L) | ||
| C. | 36.5g HCl气体. | D. | 0.5mol HCl气体 |
| A. | K+、Na+、HCO${\;}_{3}^{-}$、Cl- | B. | Fe3+、SCN-、Cl-、SO${\;}_{4}^{2-}$ | ||
| C. | NH${\;}_{4}^{+}$、Fe2+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | D. | Mg2+、Fe2+、SO${\;}_{4}^{2-}$、Cl- |
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ 其热化学方程式为:N2(g)+3H2(g)$?_{500℃/30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则1mol稀H2SO4和足量KOH反应的反应热为△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件的△H不同 |
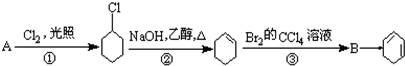
 ,B的名称是1,2-二溴环己烷.
,B的名称是1,2-二溴环己烷.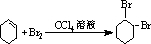 .
. .
.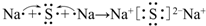 .
.