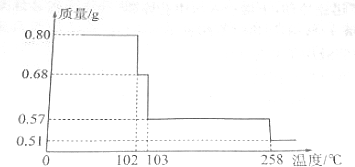
题目内容
8.一定条件下,将a mol N2与17mol H2的混合气体通入一固定体积为V L的密闭容器中,发生如下反应:(1)若反应进行到t min时,n(N2)=2mol,n(NH3)=6mol,计算a的值;此时N2的转化率是多少?
(2)在t min时,H2的体积百分数是多少?(要求简写解题过程)
分析 将a mol N2与17mol H2的混合气体通入一固定体积为V L的密闭容器中,反应进行到t min时,n(N2)=2mol,n(NH3)=6mol,则
N2(g)+3H2(g)?2NH3(g)
开始 a 17 0
转化 3 9 6
tmin 2 8 6
结合开始的量=转化量+tmin时的量、转化率=$\frac{转化的量}{开始的量}$、体积分数=$\frac{氢气的量}{tmin时气体的总物质的量}$来计算.
解答 解:将a mol N2与17mol H2的混合气体通入一固定体积为V L的密闭容器中,反应进行到t min时,n(N2)=2mol,n(NH3)=6mol,则
N2(g)+3H2(g)?2NH3(g)
开始 a 17 0
转化 3 9 6
tmin 2 8 6
(1)由上述分析可知,a=3 mol+2 mol=5mol;此时N2的转化率是$\frac{3mol}{5mol}$×100%=60%,
答:a的值为3,此时N2的转化率是60%;
(2)t时刻H2的体积分数即H2的物质的量分数为$\frac{8mol}{2mol+8mol+6mol}$×100%=50%,
答:t min时,H2的体积百分数是50%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率、体积分数的计算方法等为解答的关键,侧重分析与计算能力的考查,注意体积分数与物质的量分数的关系,题目难度不大.

| A. | 1.8 g的NH4+离子中含有的电子数为0.1NA | |
| B. | 1mol Na2O2 固体中含离子总数为4NA | |
| C. | 标准状况下,2.24L CCl4所含的共价键数为O.4NA | |
| D. | 常温常压下,92g NO2和N2O4的混合气体含有的原子数为6NA |

| A. | R是芳香烃 | B. | R含2种含氧官能团 | ||
| C. | 1mol R最多与1molH2加成 | D. | R能发生加成、取代和氧化反应 |
| A. | K+、Na+、HCO${\;}_{3}^{-}$、Cl- | B. | Fe3+、SCN-、Cl-、SO${\;}_{4}^{2-}$ | ||
| C. | NH${\;}_{4}^{+}$、Fe2+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | D. | Mg2+、Fe2+、SO${\;}_{4}^{2-}$、Cl- |
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-101.5 kJ•mol-1,该方程式的△H可表示碳的燃烧热 | |
| C. | 已知:C(s)+O2(g)=CO2(g)△H1C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1<△H2 | |
| D. | Ba(OH)2(aq)+H2SO4(aq))=BaSO4(s)+2H2O(l)△H=-2a kJ•mol-1,则任何强酸和强碱发生中和反应生成1 mol H2O(l)的反应热均为-a kJ•mol-1 |
| A. | CO2和HCOOH均属于弱电解质 | B. | CO2和HCOOH均属于有机化合物 | ||
| C. | CO2转变为HCOOH发生还原反应 | D. | 1mol CO2的体积一定等于22.4L |
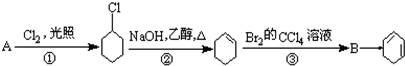
 ,B的名称是1,2-二溴环己烷.
,B的名称是1,2-二溴环己烷.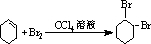 .
.