题目内容
11.SO2 气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示: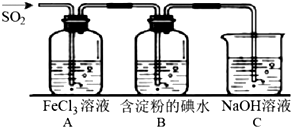
(1)若要从FeCl3溶液中提取晶体,必须进行的实验操作步骤中没有用到的玻璃仪器有.
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(2)装置 A 中的现象是溶液颜色由黄色逐渐变为浅绿色,写出 B 中发生反应的离子方程式:I2+SO2+2H2O=2I-+SO42-+4H+.
(3)在上述装置中通入过量的 SO2,为了验证A中SO2与 Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去.
方案②:往第二份试液中加入 KSCN溶液,不变红,再加入新制的氯水,溶液变红.
上述方案中不合理的是①.
分析 (1)蒸发用到蒸发皿、酒精灯、石棉网、玻璃棒,过滤用到漏斗、烧杯、玻璃棒,据此进行解答;
(2)根据装置A反应的离子方程式SO2+2Fe3++2H2O═2Fe2++SO42-+4H+进行解答;B中二氧化硫被碘单质氧化生成硫酸和碘化氢;
(3)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色.
解答 解:(1)蒸发用到蒸发皿、酒精灯、玻璃棒,过滤用到漏斗、烧杯、玻璃棒,没有用到烧瓶;
故答案为:b;
(2)装置A中SO2做还原剂,被氧化为硫酸根离子,Fe3+作氧化剂,被还原为Fe2+,反应离子方程式为:SO2+2Fe3++2H2O═2Fe2++SO42-+4H+,则A中反应的现象为:溶液颜色由黄色逐渐变为浅绿色;B中二氧化硫被碘单质氧化生成硫酸和碘化氢,离子方程式为:I2+SO2+2H2O=2I-+SO42-+4H+;
故答案为:溶液颜色由黄色逐渐变为浅绿色;I2+SO2+2H2O=2I-+SO42-+4H+;
(3)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,
故答案为:①.
点评 本题考查较综合,涉及氧化还原反应的实验,侧重学生分析能力的考查,注意浓硫酸的性质、二氧化硫的检验方法等知识,题目难度中等.

练习册系列答案
相关题目
8.下列离子在溶液中因发生氧化还原反应而不能大最共存的是( )
| A. | K+、Ba2+、OH-、SO42- | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | H3O+、NO3-、Fe2+、Na+ | D. | Cu2+、NH4+、Br-、OH- |
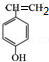
5.R是一种激素类药物,结构简式如图所示.下列说法正确的是( )

| A. | R是芳香烃 | B. | R含2种含氧官能团 | ||
| C. | 1mol R最多与1molH2加成 | D. | R能发生加成、取代和氧化反应 |
16.下列各组离子在酸性溶液中能大量共存的是( )
| A. | K+、Na+、HCO${\;}_{3}^{-}$、Cl- | B. | Fe3+、SCN-、Cl-、SO${\;}_{4}^{2-}$ | ||
| C. | NH${\;}_{4}^{+}$、Fe2+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | D. | Mg2+、Fe2+、SO${\;}_{4}^{2-}$、Cl- |
3.下列热化学方程式的书写及相关说法正确的是( )
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-101.5 kJ•mol-1,该方程式的△H可表示碳的燃烧热 | |
| C. | 已知:C(s)+O2(g)=CO2(g)△H1C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1<△H2 | |
| D. | Ba(OH)2(aq)+H2SO4(aq))=BaSO4(s)+2H2O(l)△H=-2a kJ•mol-1,则任何强酸和强碱发生中和反应生成1 mol H2O(l)的反应热均为-a kJ•mol-1 |
1.下列各氢化物中,稳定性按由强到弱的顺序排列的是( )
| A. | AsH3>NH3>PH3 | B. | PH3>AsH3>NH3 | C. | NH3>PH3>AsH3 | D. | NH3>AsH3>PH3 |
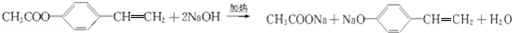 .
.