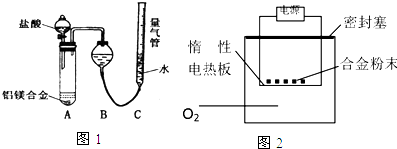
题目内容
3.下列有关元素或化合物性质的比较不正确的是( )| A. | 酸性:H2SO4>H2SO3 | B. | 氧化性:H2SO4(浓)>H2SO4(稀) | ||
| C. | 稳定性:CH4<SiH4 | D. | 碱性:Mg(OH)2>Al(OH)3 |
分析 A.一般情况下,元素的化合价越高,含氧酸的酸性越强;
B.浓度越大,氧化性越强;
C.非金属性越强,气态氢化物的稳定性越强;
D.金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:A.在H2SO4和H2SO3中,S的化合价依次为+6、+4,H2SO4是强酸,H2SO3是弱酸,酸性H2SO4>H2SO3,故A正确;
B.浓度越大,氧化性越强,氧化性:H2SO4(浓)>H2SO4(稀),故B正确;
C.非金属性C>Si,气态氢化物的稳定性CH4>SiH4,故C错误;
D.金属性Mg>Al,最高价氧化物对应水化物的碱性Mg(OH)2>Al(OH)3,故D正确;
故选C.
点评 本题考查元素周期律,侧重于学生的分析能力的考查,注意把握判断的角度,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
8.化学键的键能是指气态原子间形成1mol化学键时释放的能量.如H-I键的键能为297KJ•mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量.一个化学反应一般都有旧化学键的破坏和新化学键的形成.
下表是一些键能数据(KJ•mol-1):
回答下列问题:
由表中数据能否得出这样的结论:
(1)半径越小的原子形成的共价键越牢固(即键能越大)不能(填“能”或“不能”)
(2)非金属性越强的原子形成的共价键越牢固不能(填“能”或“不能”).能否从数据找出一些规律,请写出一条:与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;
(3)试预测C-Br键的键能范围218KJ•mol-1<C-Br键能<330KJ•mol-1.
下表是一些键能数据(KJ•mol-1):
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | C-F | 427 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
由表中数据能否得出这样的结论:
(1)半径越小的原子形成的共价键越牢固(即键能越大)不能(填“能”或“不能”)
(2)非金属性越强的原子形成的共价键越牢固不能(填“能”或“不能”).能否从数据找出一些规律,请写出一条:与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;
(3)试预测C-Br键的键能范围218KJ•mol-1<C-Br键能<330KJ•mol-1.
15.如表列出了A~R九种元素在周期表的位置:
(1)写出R单质分子的电子式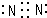 .
.
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,X的元素符号是Al,它位于元素周期表中位置第3周期第ⅢA族:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,X的元素符号是Al,它位于元素周期表中位置第3周期第ⅢA族:
12.下列化学用语正确的是( )
| A. | 8个中子的碳原子的核素符号:12C | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氢氧根离子的电子式: | D. | Cl-离子结构示意图: |
13.常见的酸性锌锰干电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、二氧化锰、氯化锌和氯化铵等组成的糊状填充物,回收处理该废电池可以得到多种化工原料,有关数据如下表所示:溶解度/(g/100g水)
不溶物溶度积:
回答下列问题:
(1)该电池的总反应式可表述为Zn+2NH4++2MnO2═Zn2++2NH3+2MnO(OH).则对应的正极反应式应为MnO2+e-+NH4+=MnO(OH)+NH3,MnO(OH)中锰元素的化合价为+3价.
(2)维持电流强度为0.5A,电池工作五分钟,理论消耗锌0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,若将滤液加热蒸发,首先应该析出的物质应是NH4Cl,原因是同温下它的溶解度远小于ZnCl2;滤渣的主要成分是MnO2、MnO(OH)和碳粉.
(3)废电池的锌皮中有少量杂质铁、将其加入稀硫酸溶解,再加入双氧水,加碱调节pH可得到Fe(OH)3沉淀.加入双氧水时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;铁离子开始沉淀时的溶液的pH应为(假定Fe3+为0.01mol•L-1)2;若上述过程不加双氧水就加碱调节pH,直接得到的沉淀中应主要含有Zn(OH)2和Fe(OH)2.
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的总反应式可表述为Zn+2NH4++2MnO2═Zn2++2NH3+2MnO(OH).则对应的正极反应式应为MnO2+e-+NH4+=MnO(OH)+NH3,MnO(OH)中锰元素的化合价为+3价.
(2)维持电流强度为0.5A,电池工作五分钟,理论消耗锌0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,若将滤液加热蒸发,首先应该析出的物质应是NH4Cl,原因是同温下它的溶解度远小于ZnCl2;滤渣的主要成分是MnO2、MnO(OH)和碳粉.
(3)废电池的锌皮中有少量杂质铁、将其加入稀硫酸溶解,再加入双氧水,加碱调节pH可得到Fe(OH)3沉淀.加入双氧水时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;铁离子开始沉淀时的溶液的pH应为(假定Fe3+为0.01mol•L-1)2;若上述过程不加双氧水就加碱调节pH,直接得到的沉淀中应主要含有Zn(OH)2和Fe(OH)2.
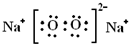 .
.
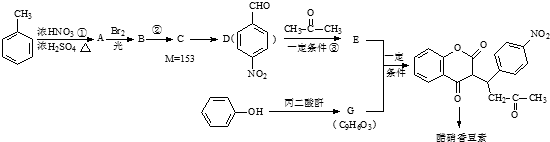

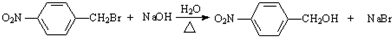 ;
;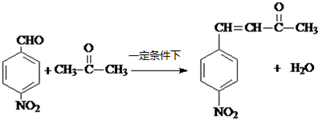 ;
;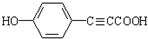 ;
;