题目内容
15.如表列出了A~R九种元素在周期表的位置:| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,X的元素符号是Al,它位于元素周期表中位置第3周期第ⅢA族:
分析 根据元素在周期表中的位置知,从A到R分别是Na、K、Mg、Al、C、O、Cl、Si、S、N元素,
(1)R单质是氮气,氮气分子中氮原子之间共用3对电子,且每个N原子还有1个孤电子对;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强;
(3)电子层数越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(4)A单质是Na,Na和水反应生成NaOH和氢气;
(5)X的原子核里有14个中子,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,氢氧化铝能溶于强酸、强碱溶液,则X是Al元素,据此分析解答.
解答 解:根据元素在周期表中的位置知,从A到R分别是Na、K、Mg、Al、C、O、Cl、Si、S、N元素,
(1)R单质是氮气,氮气分子中氮原子之间共用3对电子,且每个N原子还有1个孤电子对,氮气分子电子式为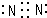 ,故答案为:
,故答案为: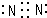 ;
;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Na>Mg>Al,所以这三种金属元素最高价氧化物的水化物碱性最强的是NaOH,故答案为:NaOH;
(3)电子层数越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,这三种元素钾离子电子层数最多、钠离子和镁离子电子层结构相同,但Na原子序数小于Mg,所以这三种元素离子半径大小顺序是K+>Na+>Mg2+,故答案为:K+>Na+>Mg2+;
(4)A单质是Na,Na和水反应生成NaOH和氢气,离子方程式为2Na+2H2O=2Na++OH-+H2↑,故答案为:2Na+2H2O=2Na++OH-+H2↑;
(5)X的原子核里有14个中子,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,氢氧化铝能溶于强酸、强碱溶液,则X是Al元素,Al位于第三周期第IIIA族,故答案为:Al;第三周期第IIIA族.
点评 本题考查元素周期表和元素周期律综合应用,为高频考点,侧重考查学生分析判断能力,明确元素周期表结构、原子结构及元素周期律内涵是解本题关键,知道离子半径大小比较方法,题目难度不大.

| A. | 加入NaOH溶液产生红褐色沉淀,则原溶液中一定有FeCl3 | |
| B. | 加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定是CO32-或SO32- | |
| C. | 先通入少量Cl2后,再加入淀粉溶液后,溶液变蓝,说明有I- | |
| D. | 往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO42- |
| A. | 酸性:H2SO4>H2SO3 | B. | 氧化性:H2SO4(浓)>H2SO4(稀) | ||
| C. | 稳定性:CH4<SiH4 | D. | 碱性:Mg(OH)2>Al(OH)3 |
| A. | 石墨周围有大量的Na+ | |
| B. | 铁棒质量增加 | |
| C. | 电子通过电解质溶液由石墨棒流向铁棒 | |
| D. | 铁棒电极发生氧化反应 |
 ;D在元素周期表中的位置为第三周期ⅢA族.
;D在元素周期表中的位置为第三周期ⅢA族. 用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.
用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理. 苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为:
苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为: