题目内容
18.铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白(可能用到的相对原子质量:Al-27)[探究一]实验方案:铝镁合金$\stackrel{NaOH溶液}{→}$测定剩余固体质量.
实验步骤:
(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol•L-1NaOH溶液中,充分反应.NaOH溶液的体积V≥95ml.
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将偏高(“偏高”或“偏低”)
[探究二]实验方案:铝镁合金$\stackrel{盐酸}{→}$测定生成气体的体积(实验装置如图1)
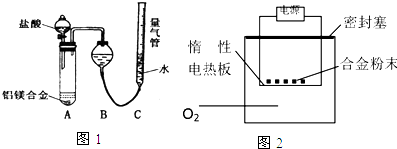
问题讨论:
为使测定结果尽可能精确,实验中应注意的问题是(写出可能的一点):检查装置的气密性;或合金完全溶解、或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平、或待冷却至室温再读体积等.
[探究三]实验方案:称量m g铝镁合金粉末.放在如图2所示装置的惰性电热板上,通电使其充分灼烧.
问题讨论:欲计算Mg的质量分数,该实验中还需测定的数据是灼烧后固体的质量.
[实验拓展]请你另设计一个实验方案,测定该铝镁合金中镁的质量分数(书写形式可以模仿探究一、二实验方案)铝镁合金$\stackrel{足量盐酸}{→}$溶液$\stackrel{NaOH溶液}{→}$测定固体质量或铝镁合金$\stackrel{足量盐酸}{→}$溶液$\stackrel{足量氨水}{→}$测定固体质量.
分析 【探究一】:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(1)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
【探究二】:装置的气密性、合金是否完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积)等会影响测定结果;
【探究三】:Mg、Al都能够与氧气化学反应生成氧化物;
【实验拓展】测定该铝镁合金中镁的质量分数也可以称量一定量合金溶于足量盐酸,溶液中加入过量氢氧化钠溶液,过滤得到沉淀为氢氧化镁沉淀,计算得到;也可以称量一定量的合金加入足量盐酸溶解后加入过量氨水过滤得到氢氧化铝和氢氧化镁沉淀质量,依据元素守恒计算得到.
解答 解:【探究一】:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(1)含镁为5%时,金属铝的含量最低,5.4g合金中铝的质量为,5.4g×(1-5%)=5.4×95%g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
5.4×95%g V×10-3L×2.0mol/L
所以54g:(5.4×95%g)=2mol:(V×10-3L×2.0mol/L),
解得:V=95mL,故V(NaOH溶液)≥95mL;
故答案为:95mL;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,故答案为:偏高;
【探究二】:反应中装置的气密性、合金是否完全溶解都会影响测定结果,或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平、或待冷却至室温再读体积等,
故答案为:检查装置的气密性;或合金完全溶解、或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平、或待冷却至室温再读体积等;
【探究三】
Mg、Al均与氧气反应,生成金属氧化物,则还需测定生成物的质量,故答案为:灼烧后固体的质量;
【实验拓展】测定该铝镁合金中镁的质量分数也可以称量一定量合金溶于足量盐酸,溶液中加入过量氢氧化钠溶液,过滤得到沉淀为氢氧化镁沉淀,计算得到;也可以称量一定量的合金加入足量盐酸溶解后加入过量氨水过滤得到氢氧化铝和氢氧化镁沉淀质量,依据元素守恒计算得到,具体实验方案为:铝镁合金$\stackrel{足量盐酸}{→}$溶液$\stackrel{NaOH溶液}{→}$测定固体质量或铝镁合金$\stackrel{足量盐酸}{→}$溶液$\stackrel{足量氨水}{→}$测定固体质量,
故答案为:铝镁合金$\stackrel{足量盐酸}{→}$溶液$\stackrel{NaOH溶液}{→}$测定固体质量或铝镁合金$\stackrel{足量盐酸}{→}$溶液$\stackrel{足量氨水}{→}$测定固体质量.
点评 本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.

| A. | 在任何条件下,化学平衡常数是一个恒定量 | |
| B. | 改变反应物浓度或生成物浓度都会改变平衡常数K | |
| C. | 从平衡常数K的大小不能推断一个反应进行的程度 | |
| D. | 平衡常数K只与温度有关,与反应物的浓度无关 |
| A. | 加入NaOH溶液产生红褐色沉淀,则原溶液中一定有FeCl3 | |
| B. | 加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定是CO32-或SO32- | |
| C. | 先通入少量Cl2后,再加入淀粉溶液后,溶液变蓝,说明有I- | |
| D. | 往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO42- |
| A. | 酸性:H2SO4>H2SO3 | B. | 氧化性:H2SO4(浓)>H2SO4(稀) | ||
| C. | 稳定性:CH4<SiH4 | D. | 碱性:Mg(OH)2>Al(OH)3 |
| A. | 石墨周围有大量的Na+ | |
| B. | 铁棒质量增加 | |
| C. | 电子通过电解质溶液由石墨棒流向铁棒 | |
| D. | 铁棒电极发生氧化反应 |
| A. | 往Na[Al(OH)4]溶液中通入过量CO22[Al(OH)4]-+CO2=2Al(OH)3↓+CO32-+H2O | |
| B. | Na2SiO3溶液与稀醋酸混合SiO32-+2H+=H2SiO3↓ | |
| C. | 钠与CuSO4溶液反应2Na+Cu2+=Cu+2Na+ | |
| D. | 往Na2SO3溶液中滴加双氧水 H2O2+SO32-=SO42-+H2O |


 ;其反应类型是消去反应.
;其反应类型是消去反应. 苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为:
苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为: