题目内容
15.有机物M是一种香料的合成原料,其结构简式如图所示.下列有关M的说法正确的是( )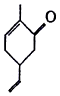
| A. | 可以发生氧化反应 | B. | 分子式为C9H10O | ||
| C. | 分子中所有原子都处于同一平面上 | D. | 能使溴的四氯化碳溶液褪色 |
分析 由结构可知分子式,分子中含碳碳双键、羰基,结合烯烃、酮的性质来解答.
解答 解:A.含碳碳双键,可发生氧化反应,故A正确;
B.由结构可知分子式为C9H14O,故B错误;
C.只有双键、羰基为平面结构,其它C均为四面体构型,则所有原子不可能共面,故C错误;
D.含碳双键,能使溴的四氯化碳溶液褪色,故D正确;
故选AD.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应等为解答关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.

练习册系列答案
相关题目
5. 1L某混合溶液中可能含有的离子如表:
1L某混合溶液中可能含有的离子如表:
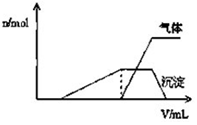
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
①则该溶液中确定含有的离子有H+、NH4+、Al3+;
②肯定不存在的离子有Mg2+、AlO2-、CO32-.
③写出沉淀减少过程中发生的离子方程式Al(OH)3+OH-═AlO2-+H2O
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
①原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.
②从起始至通入Cl2的体积为22.4L时,溶液中发生反应的总离子方程式为4Cl2+2Br-+6I-=8Cl-+Br2+3I2.
 1L某混合溶液中可能含有的离子如表:
1L某混合溶液中可能含有的离子如表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ Mg2+ |
| 可能大量含有的阴离子 | Cl-Br-I?AlO2- CO32- |
①则该溶液中确定含有的离子有H+、NH4+、Al3+;
②肯定不存在的离子有Mg2+、AlO2-、CO32-.
③写出沉淀减少过程中发生的离子方程式Al(OH)3+OH-═AlO2-+H2O
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | a mol | 0 | 0 |
②从起始至通入Cl2的体积为22.4L时,溶液中发生反应的总离子方程式为4Cl2+2Br-+6I-=8Cl-+Br2+3I2.
6.下列说法正确的是( )
| A. | 碘单质的升华过程中不存在化学键破坏的过程 | |
| B. | NaCl溶于水后,因为共价键被破坏,从而形成了Na+和Cl- | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 |
3.下列叙述正确的是( )
| A. | 可用排水法收集二氧化氮气体 | |
| B. | 浓硝酸存放于棕色广口试剂瓶中 | |
| C. | 配制氯化亚铁溶液时,将氯化亚铁固体溶解在蒸馏水中加少量盐酸即可 | |
| D. | 蒸馏时应先向冷凝管中通入冷凝水再加热 |
10.下列生活、生产的运用中涉及了氧化还原反应的是( )
| A. | 用Al(OH)3治疗胃酸过多 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用金属铝进行铝热法炼铁 | D. | 用水玻璃制备硅胶和木材防火剂 |
20. 雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.
雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.
请回答下列问题:
(1)将一定量的某利M2.5样品用蒸馏水溶解制成待测试样(忽略OH-).常温下测得该训试样的组成及其浓度如表一:根据表一中数据判断该试样的pH=4.
表一:
(2)汽车尾气中NOx和CO的生成:①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是D.
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1:1:2D.氧气的转化率不再变化
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8KJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5KJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.下列可作为洗涤含SO2的烟气的洗涤剂的是AB.
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl2饱和溶液 D.酸性CaCl2饱和溶液
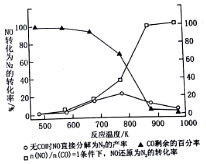
(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示.若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为NO的分解反应是放热反应,升温有利于反应逆向进行,在$\frac{n(NO)}{n(CO)}$=1的条件下,为更好的除去NOx物质,应控制的最佳温度在870K左右.
(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如表二:
表二:
①写出NO与活性炭反应的化学方程式C+2NO?N2+CO2,②若T1<T2,则该反应的△H<O (填”>”、“<”或“=”).
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为80%.
 雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.
雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.请回答下列问题:
(1)将一定量的某利M2.5样品用蒸馏水溶解制成待测试样(忽略OH-).常温下测得该训试样的组成及其浓度如表一:根据表一中数据判断该试样的pH=4.
表一:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1:1:2D.氧气的转化率不再变化
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8KJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5KJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.下列可作为洗涤含SO2的烟气的洗涤剂的是AB.
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl2饱和溶液 D.酸性CaCl2饱和溶液
(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示.若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为NO的分解反应是放热反应,升温有利于反应逆向进行,在$\frac{n(NO)}{n(CO)}$=1的条件下,为更好的除去NOx物质,应控制的最佳温度在870K左右.
(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如表二:
表二:
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为80%.
7.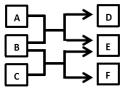 X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )
 X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )| A. | 由X、Y、Z、W四种元素组成的盐溶液pH小于7 | |
| B. | 化合物F中含有共价键和离子键 | |
| C. | 0.1molB与足量C完全反应共转移电子数为0.2NA | |
| D. | Z元素的最高正价为+6 |
4.下列说法正确的是( )
| A. | 1mol蔗糖完全水解生成葡萄糖分子数为2 NA | |
| B. | 在氢氧碱性燃料电池中,若正极消耗22.4L气体(标准状况),则转移电子数为2NA | |
| C. | 16.0 gCuO和Cu2S的混合物含阴离子数为0.2NA | |
| D. | 2.24L(标准状况)一氯甲烷分子中含共价键数为0.4NA |