题目内容
18.某溶液中加入Al粉有H2放出,在该溶液中可能大量共存的离子组是( )| A. | Na+、SO42-、Cl-、NO3- | B. | K+、Fe3+、Cl-、SCN- | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Al3+、K+、HS-、Na+ |
分析 加入Al粉有H2放出,为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能结合生成络离子,不能相互促进水解等,则离子大量共存,以此来解答.
解答 解:A.碱溶液中该组离子之间不反应,可大量共存,故A选;
B.Fe3+、SCN-结合生成络离子,不能共存,故B不选;
C.碱性溶液不能大量存在H+、Mg2+,酸溶液中Al、H+、NO3-发生氧化还原反应不生成氢气,故C不选;
D.Al3+、HS-相互促进水解,不能共存,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、水解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
19.氮原子 2p 亚层上的 3 个电子不相同的是( )
| A. | 能量 | B. | 电子云形状 | C. | 电子云伸展方向 | D. | 自旋状态 |
9.将2mol X和2mol Y充入2L密闭容器中发生反应:X(g)+3Y(g)?2Z(g)+a Q(g).2min达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
| A. | Y的转化率为60% | B. | 反应速率v(Y)=0.3 mol/(L•min) | ||
| C. | a的值为2 | D. | 平衡时X的浓度为0.2 mol/L |
6.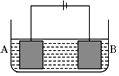 按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )
按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )
 按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )
按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )| A. | 4:1 | B. | 3:1 | C. | 2:1 | D. | 1:1 |
13.有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰好为A原子L层电子数的2倍.则A、B分别是( )
| A. | 硅原子和钠原子 | B. | 铜原子和氦原子 | C. | 碳原子和铝原子 | D. | 氧原子和碳原子 |
10.某工厂排放的污水只可能含Na+、K+、NH4+、Mg2+、Fe3+、SO32-、SO42-和Cl-中的几种(忽略由水电离产生的H+、OH-).将试样平均分成甲、乙、丙各l00mL三份,每次均加入足量的试剂,设计如下实验.下列说法正确的是( )
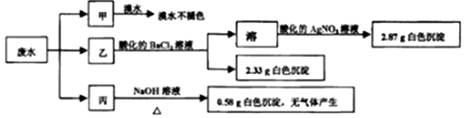

| A. | 废水可能含有Na+、K+、Fe3+ | |
| B. | 可能存在的离子用焰色反应进一步检验确认 | |
| C. | 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol•L-1 | |
| D. | 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+ |
7.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
现在体积为1L的密闭容器中,充入CO2和H2.实验测得反应体系中物质的物质的量与时间关系如下表,
回答下列问题:
(1)表格中的n1=0.75mol
(2)0-5min内 v (H2)=0.3mol•L-1•min-1
(3)该条件下CO2的平衡转化率为75%.
现在体积为1L的密闭容器中,充入CO2和H2.实验测得反应体系中物质的物质的量与时间关系如下表,
| n(CO2) | n(H2) | n(CH3OH(g) | n(H2O(g) | |
| 0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
| 5min | 0.50mol | 0.50mol | ||
| 10min | 0.25mol | 0.75mol | ||
| 15min | 0.25mol | n1 |
(1)表格中的n1=0.75mol
(2)0-5min内 v (H2)=0.3mol•L-1•min-1
(3)该条件下CO2的平衡转化率为75%.
8.下列关于有机物的说法中正确的是( )
| A. | 棉花、羊毛、丝绸的主要成分均为蛋白质 | |
| B. | 丙烷中的3个碳原子一定在同一平面上 | |
| C. | 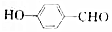 中含有的官能团有3种 中含有的官能团有3种 | |
| D. | 乙烯使溴水和酸性KMnO4溶液褪色的原理相同 |