题目内容
13.有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰好为A原子L层电子数的2倍.则A、B分别是( )| A. | 硅原子和钠原子 | B. | 铜原子和氦原子 | C. | 碳原子和铝原子 | D. | 氧原子和碳原子 |
分析 A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰好为A原子L层电子数的2倍,则A的L层电子数为4,B的L层电子数为8,以此来解答.
解答 解:B原子的L层电子数恰好为A原子L层电子数的2倍,则A的L层电子数为4,B的L层电子数为8,则A只有2个电子层,A为C原子;
B的L层为8个电子,A原子的M层比B原子的M层少3个电子,可知B的M层电子数为3,则B为Al原子,
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握电子排布规律来推断元素为解答的关键,侧重分析与应用能力的考查,注意L层最多为8个电子,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
4.下列实验方案设计中,能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验FeCl3溶液中是否存在FeCl2 | 向溶液中滴加KSCN溶液后再滴加氯水 |
| B | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| C | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硫酸并过滤 |
| D | 检验未知溶液一定含有CO32- | 加入稀盐酸有无色无味的气体生成 |
| A. | A | B. | B | C. | C | D. | D |
1.称取(NH4)2SO4和NH4HSO4混合物样品7.24g,加入含0.1mol NaOH的溶液,完全反应后加热,生成NH3 1792mL(标准状况),则下列说法正确的是( )
| A. | NaOH只与NH4HSO4反应 | |
| B. | (NH4)2SO4在水中的电离方程式:(NH4)2SO4=NH4++SO42- | |
| C. | NH4HSO4的物质的量是0.04 mol | |
| D. | (NH4)2SO4和NH4HSO4物质的量之比是1.87:1 |
18.某溶液中加入Al粉有H2放出,在该溶液中可能大量共存的离子组是( )
| A. | Na+、SO42-、Cl-、NO3- | B. | K+、Fe3+、Cl-、SCN- | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Al3+、K+、HS-、Na+ |
5.在四个不同的容器中,在不同的条件下进行合成氨反应.根据下列在相同时间内测定的结果判断,生成氨气的速率最快的是( )
| A. | V(N2)=0.2 mol•L-1•min-1 | B. | V(H2)=0.1 mol•L-1•min-1 | ||
| C. | V(NH3)=0.15 mol•L-1•min-1 | D. | V(H2)=0.4 mol•L-1•min-1 |
3.下列物质的每步转化在给定条件下能一步实现且较合理的是( )
| A. | Cu2(OH)2CO3 $\stackrel{H_{2}SO_{4}}{→}$ CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| B. | 饱和食盐水$\stackrel{NH_{3}+CO_{2}}{→}$NaHCO3 $\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$ Mg(OH)2 $\stackrel{△}{→}$ MgO $\stackrel{电解}{→}$ Mg | |
| D. | NH3 $→_{催化剂,△}^{O_{2}}$ N2 $\stackrel{O_{2}+H_{2}O}{→}$HNO3 |
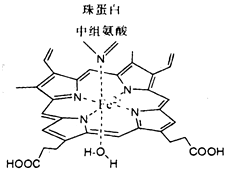 红细胞中血红素结构如图所示,回答下列问题:
红细胞中血红素结构如图所示,回答下列问题: .
. 燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.
燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.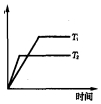 研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下: