题目内容
1.下列离子方程式书写正确的是( )| A. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 向硫酸溶液中加入Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
分析 A.反应生成氢氧化铝和氯化铵;
B.碳酸氢根离子在离子反应中保留化学式;
C.反应生成硫酸钡和水;
D.反应生成氢氧化铝和碳酸氢钠.
解答 解:A.氯化铝溶液中加入过量氨水的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故A错误;
B.NaHCO3溶液中加入盐酸的离子反应为HCO3-+H+═H2O+CO2↑,故B错误;
C.向硫酸溶液中加入Ba(OH)2溶液的离子反应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C正确;
D.偏铝酸钠溶液中通入过量二氧化碳的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
11.用NA表示阿伏加德罗常数值.下列叙述正确的是( )
| A. | 标况下,1molC6H1206含氧原子数为6NA | |
| B. | 0.1moICl2与足量水充分混合,转移电子数为0.1NA | |
| C. | 25℃,pH=13的Ba(OH)2溶液含有OH-数目为0.2NA | |
| D. | 22.4L N2和NH3混合气体含共用电子对数目为3NA |
16.下列有关四个常用电化学装置的叙述正确的是( )
| A. | 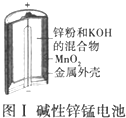 图Ⅰ所示电池中,MnO2的作用是催化剂 | |
| B. | 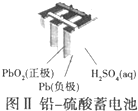 图Ⅱ所示电池工作时,负极质量减轻 | |
| C. | 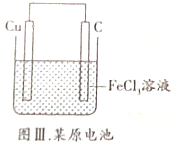 图Ⅲ所示装置工作过程中,Cu作正极 | |
| D. | 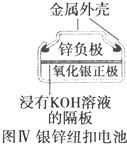 图Ⅳ所示电池为一次电池 |
13.下列有关物质的性质与其应用不相对应的是( )
| A. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| B. | MgO、Al2O3的熔点很高,可制作耐高温材料 | |
| C. | 二氧化硫具有漂白性,可用于漂白纸浆和草帽辫 | |
| D. | 铜盐能使蛋白质变性,游泳场馆常用硫酸铜作池水消毒剂 |
10.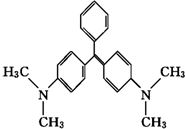 孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸.其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )
孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸.其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )
 孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸.其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )
孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸.其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )| A. | 孔雀石绿的分子式为C23H25N2 | |
| B. | 1 mol孔雀石绿在一定条件下最多可与6 mol H2发生加成反应 | |
| C. | 孔雀石绿属于芳香族化合物 | |
| D. | 孔雀石绿苯环上的一氯取代物有6种 |
11.对下列有关物质同分异构体(不考虑立体异构)数目的分析中正确的是( )
| A | B | C | D | |
| 分子式 | C3H8O | C4H8Cl2 | C7H16 | C8H10 |
| 限定条件 | 能使KMnO4溶液褪色 | 分子中含有2个甲基 | 分子中含有3个甲基 | 芳香烃、能得到三种一硝基化物 |
| 数目 | 2 | 3 | 2 | 3 |
| A. | A | B. | B | C. | C | D. | D |
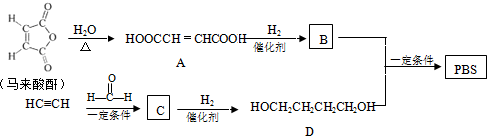
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 →CH≡CH的化学方程式(注明条件)
→CH≡CH的化学方程式(注明条件) 和
和 合成CH3CH2CH2CH2OH的反应流程图(有机物用结构简式表示,必须注明反应条件).
合成CH3CH2CH2CH2OH的反应流程图(有机物用结构简式表示,必须注明反应条件).