题目内容
16.下列有关四个常用电化学装置的叙述正确的是( )| A. | 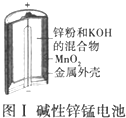 图Ⅰ所示电池中,MnO2的作用是催化剂 | |
| B. | 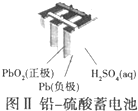 图Ⅱ所示电池工作时,负极质量减轻 | |
| C. | 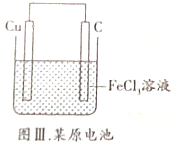 图Ⅲ所示装置工作过程中,Cu作正极 | |
| D. | 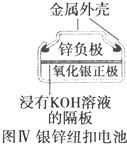 图Ⅳ所示电池为一次电池 |
分析 A.二氧化锰作正极;
B.根据放电过程中负极生成硫酸铅;
C.Cu失电子作负极;
D.银锌电池属于一次电池.
解答 解:A.该电池反应中二氧化锰得到电子被还原,为原电池的正极,故A错误;
B.铅蓄电池放电时电池反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极Pb反应生成硫酸铅,硫酸铅难溶于水,所以负极的质量增大,故B错误;
C.Cu与三氯化铁反应时,Cu失电子,所以形成原电池中Cu失电子作负极,故C错误;
D.可以反复充电放电的电池属于二次电池,银锌电池属于一次电池,故D正确;
故选D.
点评 本题考查原电池和电解池原理,侧重于学生的分析能力的考查,明确电极上发生的反应是解本题关键,题目难度不大.

练习册系列答案
相关题目
6.用1L1.5mol•L-1的氢氧化钠吸收标准状况下22.4LCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比为( )
| A. | 1:3 | B. | 1:2 | C. | 1:1 | D. | 3:2 |
7.一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染.已知:
①CH4(g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H1=-574kJ•mol-1
②CH4 (g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H2=-1160kJ•mol-1
下列选项不正确的是( )
①CH4(g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H1=-574kJ•mol-1
②CH4 (g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H2=-1160kJ•mol-1
下列选项不正确的是( )
| A. | CH4 (g)+2NO2 (g)═N2 (g)+CO2 (g)+2H2 O(g)△H=-867 kJ•mol-1 | |
| B. | CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(l)△H3<△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8mol |
1.下列离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 向硫酸溶液中加入Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
8.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4LSO3所含原子数为4NA | |
| B. | 1.0L浓度为1.0mol/L的一元酸溶液中含有NA个氢离子 | |
| C. | 7.8g Na2O2加入过量水中,反应转移的电子数为0.2NA | |
| D. | 同温同压下,原子数均为NA的氢气和氦气具有不同的体积 |
5.去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示.下列说法正确的是( )

| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 1mol去甲肾上腺素分子在一定条件下可以和4molH2发生加成反应 | |
| C. | 1mol去甲肾上腺素最多能与含3mol Br2的浓溴水发生取代反应 | |
| D. | 去甲肾上腺素能与氢氧化钠溶液反应,但不能与盐酸反应 |