题目内容
13.下列有关物质的性质与其应用不相对应的是( )| A. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| B. | MgO、Al2O3的熔点很高,可制作耐高温材料 | |
| C. | 二氧化硫具有漂白性,可用于漂白纸浆和草帽辫 | |
| D. | 铜盐能使蛋白质变性,游泳场馆常用硫酸铜作池水消毒剂 |
分析 A.二氧化硅能够与氢氟酸反应;
B.耐高温材料应具有较高的熔沸点;
C.二氧化硫能够与有色物质化合生成无色物质;
D.依据蛋白质变性的性质解答.
解答 解:A.二氧化硅能够与氢氟酸反应,石英主要成分二氧化硅,氢氟酸能够腐蚀玻璃,所以不能用石英器皿盛放氢氟酸,故A错误;
B.MgO、Al2O3的熔点很高,可制作耐高温材料,故B正确;
C.二氧化硫能够与有色物质化合生成无色物质,具有漂白性,能漂白纸浆和草帽辫,故C正确;
D.重金属盐、强氧化性物质都能使蛋白质变性,故D正确;
故选:A.
点评 本题考查了二氧化硅、氧化镁、氧化铝、二氧化硫、蛋白质的性质,熟悉蛋白质的变性与盐析过程、二氧化硫的漂白性是解题关键,题目难度不大.

练习册系列答案
相关题目
3.常温下,向20mL 0.2mol.L-1二元酸H2A溶液中滴加0.2mol.L-lNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )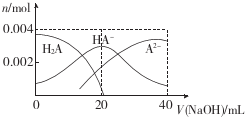

| A. | 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA-)>c( A2-)>c( OH-)>((H+) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大 | |
| C. | 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大 | |
| D. | 当V(NaOH)=40 mL时,升高温度,$\frac{c(N{a}^{+})}{c({A}^{2-})}$减小 |
1.下列离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 向硫酸溶液中加入Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
8.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4LSO3所含原子数为4NA | |
| B. | 1.0L浓度为1.0mol/L的一元酸溶液中含有NA个氢离子 | |
| C. | 7.8g Na2O2加入过量水中,反应转移的电子数为0.2NA | |
| D. | 同温同压下,原子数均为NA的氢气和氦气具有不同的体积 |
18.缓冲溶液可以抗御少量酸碱对溶液pH的影响.人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定.己知在人体正常体温时,反应H2CO3?HCO3-+H+的Ka=10-6.1mol•L-1,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3.则下列判断正确的是( )
| A. | 正常人血液内Kw=10-14 | |
| B. | 由题给数据可算得正常人血液的pH约为7.4 | |
| C. | 正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 当过量的碱进入血液中时,只发生HCO3-+OH-=CO32-+H2O的反应 |
5.去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示.下列说法正确的是( )

| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 1mol去甲肾上腺素分子在一定条件下可以和4molH2发生加成反应 | |
| C. | 1mol去甲肾上腺素最多能与含3mol Br2的浓溴水发生取代反应 | |
| D. | 去甲肾上腺素能与氢氧化钠溶液反应,但不能与盐酸反应 |
 某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池.
某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池. 按如图进行电解实验(A、B、C、D均为惰性电极).
按如图进行电解实验(A、B、C、D均为惰性电极).