题目内容
7.11.6gFe3O4加到100mL某浓度的盐酸中,再加入9.8g铁粉,反应停止时,溶液中无固体存在.向溶液中滴加硫氰化钾溶液,未见颜色变化,为了中和过量的盐酸(不考虑盐酸的挥发),且使铁完全转化成Fe(OH)2,共消耗5.0mol•L-1NaOH溶液160mL.则原盐酸的物质的量浓度为( )| A. | 2 mol•L-1 | B. | 4 mol•L-1 | C. | 6 mol•L-1 | D. | 8 mol•L-1 |
分析 该过程中发生的反应为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O、Fe+2HCl=FeCl2+H2↑、2FeCl3+Fe=3FeCl2、FeCl2+2NaOH=Fe(OH)2↓+2NaCl、NaOH+HCl=NaCl+H2O,最终溶液中的溶质是NaCl,根据原子守恒计算盐酸的浓度.
解答 解:该过程中发生的反应为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O、Fe+2HCl=FeCl2+H2↑、2FeCl3+Fe=3FeCl2、FeCl2+2NaOH=Fe(OH)2↓+2NaCl、NaOH+HCl=NaCl+H2O,最终溶液中的溶质是NaCl,原子守恒得n(NaOH)=n(NaCl)=n(HCl),则c(HCl)=$\frac{n(NaOH)}{V(HCl)}$=$\frac{5mol/L×0.16L}{0.1L}$=8 mol•L-1,
故选D.
点评 本题考查了方程式的计算,明确最终溶液中的溶质是解此题关键,再结合原子守恒解答即可,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
16.工业制取盐酸是用氯碱工业的氢气和氯气反应后得到HCl气体溶于水制得的,有关制取HCl气体的方法正确的是( )
| A. | 氢气和氯气光照爆炸得到HCl气体 | |
| B. | 在HCl合成塔,点燃的氢气中通入氯气产生HCl | |
| C. | 氯气在空气中点燃后通入氢气产生HCl | |
| D. | 点燃氢气和氯气混合气体产生HCl气体 |
15.下列实验正确的是 ( )
| A. | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊,确定NaHCO3溶液中是否混有Na2CO3 | |
| B. | 苯酚沾到皮肤上,先用酒精清洗,再用水冲洗 | |
| C. | 将10g ZnSO4•7H2O溶解在90g水中,配制10%ZnSO4溶液 | |
| D. | 向稀硫酸中加几滴CuSO4溶液,可提高纯锌与稀硫酸的反应速率. |
2.将一小块Na投入到FeCl3溶液中,可以观察到的现象是( )
| A. | 生成白色沉淀、有气体产生 | B. | 生成红褐色沉淀、有气体产生 | ||
| C. | 生成红褐色沉淀 | D. | 生成黑色沉淀、有气体产生 |
12.下列有关描述及离子方程式的书写正确的是( )
| A. | HSO3-在溶液中发生水解:HSO3-+H2O?SO32-+H3O+ | |
| B. | 向Mg(OH)2浊液中滴加FeCl3溶液生成红褐色沉淀:3OH-+Fe3+=Fe(OH)3↓ | |
| C. | 碳酸氢钠溶液显碱性:HCO3-+H2O?H2CO3+OH- | |
| D. | 惰性电极电解MgCl2溶液:Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$OH-+Cl2↑+H2↑ |
19.在2L Al2(SO4)3和(NH4)2SO4的混合溶液中加入3mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到3mol NH3,则原溶液中Al3+的浓度为( )
| A. | 0.75 mol/L | B. | 1.5 mol/L | C. | 0.25 mol/L | D. | 0.5 mol/L |
17.在固定体积的密闭容器中,一定温度下,加入2molBr2,1molH2,发生反应:Br2(g)+H2(g)?2HBr(g),到达平衡时,HBr的浓度为W mol/L,在相同条件下,按下列情况充入物质到达平衡时,HBr的浓度仍为W mol/L的是( )
| A. | 1molBr2+2molHBr | B. | 3molHBr | C. | 4molBr2+2molH2 | D. | 2molHBr |
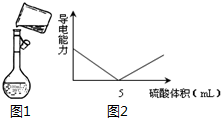 用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释;④冷却,转移、洗涤摇匀;⑤定容、摇匀;⑥转入试剂瓶,贴标签.
用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释;④冷却,转移、洗涤摇匀;⑤定容、摇匀;⑥转入试剂瓶,贴标签.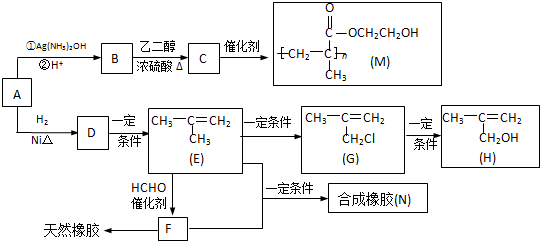
 ;
; .
.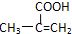 ,该不饱和酸有多种同分异构体,属于酯类且含有碳碳双键的同分异构体共有5种.
,该不饱和酸有多种同分异构体,属于酯类且含有碳碳双键的同分异构体共有5种.