题目内容
18. 用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释;④冷却,转移、洗涤摇匀;⑤定容、摇匀;⑥转入试剂瓶,贴标签.
用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释;④冷却,转移、洗涤摇匀;⑤定容、摇匀;⑥转入试剂瓶,贴标签.回答下列问题
(1)所需浓硫酸的体积是8.2mL.量取浓硫酸所用的量筒的规格是a(填编号,下同);选用的容量瓶的规格是e.
a.10mL b.50mL c.100mL d.200mLe.500mLf.1000mL(2)第③步实验的操作步骤是将浓硫酸沿着烧杯壁缓缓注入水中,同时用玻璃棒不断搅拌.
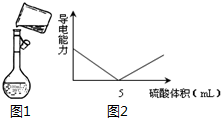
(3)图1是某同学转移溶液的示意图,图中的错误是未用玻璃棒引流.
(4)下列操作可能使所配溶液的物质的量浓度偏高的是e(填序号,下同),对配制结果没有影响的是a.
a.选用的容量瓶内有少量的蒸馏水
b.往容量瓶转移溶液时,有少量液体溅出
c.未洗涤稀释浓H2SO4的小烧杯
d.所用的浓硫酸长时间放置在密封不好的容器中
e.用量筒量取浓硫酸时,仰视读数
(5)将此溶液逐滴加入20mL Ba(OH)2溶液中,溶液的导电性变化如图2所示.则此氢氧化钡溶液的浓度为0.075mol/L.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据配制溶液的体积选择需要容量瓶规格,依据溶液稀释过程中溶质的物质的量保持不变计算需要浓硫酸的体积,依据浓硫酸体积选择量筒规格;
(2)依据浓硫酸稀释的正确操作解答;
(3)向容量瓶中转移液体,应使用玻璃棒引流;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(5)当加入的硫酸能将Ba(OH)2恰好完全中和时,溶液的导电性最差,据此分析.
解答 解:(1)98%的浓硫酸(密度为1.84g/mL),物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,配制500mL 0.30mol/L 稀硫酸,需要使用500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量保持不变得:18.4mol/L×V=500mL×0.30mol/L,解得V=8.2mL,应选择10mL量筒;
故答案为:8.2;a;e;
(2)浓硫酸稀释的正确操作为:将浓硫酸沿着烧杯壁缓缓注入水中,同时用玻璃棒不断搅拌;
故答案为:将浓硫酸沿着烧杯壁缓缓注入水中,同时用玻璃棒不断搅拌;
(3)向容量瓶中转移液体,应使用玻璃棒引流,所以图中操作错误之处为:未用玻璃棒引流;
故答案为:未用玻璃棒引流;
(4)a.选用的容量瓶内有少量的蒸馏水,对溶质的物质的量和溶液的体积都不会产生影响,溶液浓度不受影响;
b.往容量瓶转移溶液时,有少量液体溅出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
c.未洗涤稀释浓H2SO4的小烧杯,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
d.所用的浓硫酸长时间放置在密封不好的容器中,则浓硫酸浓度偏低,量取的浓硫酸中含有硫酸的物质的量偏小,溶液浓度偏低;
e.用量筒量取浓硫酸时,仰视读数,导致量取浓硫酸体积偏大,硫酸的物质的量偏大,导致溶液浓度偏高;
所以:使所配溶液的物质的量浓度偏高的是e,对配制结果没有影响的是a;
故答案为:e;a;
(5)当加入的硫酸能将Ba(OH)2恰好完全中和时,溶液的导电性最差,而此时加入的硫酸的体积为5mL,设Ba(OH)2溶液的浓度为xmol/L,根据反应可知:
Ba(OH)2 +H2SO4 =BaSO4 +2H2O
1 1
20mL×xmol/L 0.3mol/L×5mL
可知:$\frac{1}{20x}$=$\frac{1}{0.3×5}$
解得:x=0.075mol/L,
故答案为:0.075.
点评 本题考查了一定物质的量浓度溶液配制及有关方程式计算,明确配制原理及发生反应实质是解题关键,题目难度不大.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案某温度下,取10g该溶液于烧杯中,滴入溶质质量分数为50%的K2CO3饱和溶液.滴入碳酸钾溶液质量与生成沉淀质量的关系如图所示.下列说法错误的是:( )
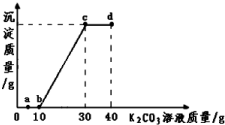
| A. | 向a点对应的溶液中滴加无色酚酞试液,溶液为无色 | |
| B. | 该温度下,K2CO3的溶解度为100g | |
| C. | 由图象可得,10g该溶液中氯化钙的质量约为8g | |
| D. | b、c、d三点对应的溶液中分别含有两种溶质 |
 铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:
铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.006mol/(L•min);
(3)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2. K2FeO4在处理水的过程中所起的作用有杀菌消毒、净水(吸附悬浮物);
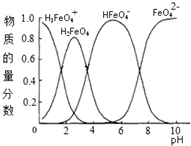
(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如图所示:
(1)pH=2时溶液存在如下等量关系:c(K+)=2c(H2FeO4)+2c(H3FeO4+)+2c(HFeO4-);
(2)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42-+H2O.
| 族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ④ | ⑦ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑥ | ⑧ | ⑨ | ⑩ |
(2)元素①②③最高价氧化物对应的水化物中呈两性的物质的名称是氢氧化铝.
写出实验室制取该物质,反应的离子方程式为:Al3++3NH3.H2O=Al(OH)3+3NH4+.
(3)在检验某溶液是否含有①元素时,常用焰色反应.
(4)④和⑦形成化合物的化学键为:共价键.
(5)元素⑥.⑨最高价氧化物的化学式分别为:P2O5、Cl2O7.
| A. | 标准状况下,22.4L SO3中含有氧原子数目为3NA | |
| B. | 常温常压下,56g铁与足量硫粉反应,转移的电子数目为3NA | |
| C. | 标准状况下,22.4L Cl2溶于足量水中,转移的电子数目为NA | |
| D. | 标准状况下,22.4L NH3溶于水配成1L溶液,其浓度为1mol/L |
| A. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 在酸性条件下,用H2O2将I-氧化为I2:H2O2+2I-+2H+=I2+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | NaHCO3溶液中加入少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| A. | 2 mol•L-1 | B. | 4 mol•L-1 | C. | 6 mol•L-1 | D. | 8 mol•L-1 |