题目内容
16.工业制取盐酸是用氯碱工业的氢气和氯气反应后得到HCl气体溶于水制得的,有关制取HCl气体的方法正确的是( )| A. | 氢气和氯气光照爆炸得到HCl气体 | |
| B. | 在HCl合成塔,点燃的氢气中通入氯气产生HCl | |
| C. | 氯气在空气中点燃后通入氢气产生HCl | |
| D. | 点燃氢气和氯气混合气体产生HCl气体 |
分析 氢气在氯气中能够燃烧,氯气在空气中不燃烧,据此分析.
解答 解:A.氢气和氯气光照爆炸得到HCl气体,该反应不适合于工业生产,故A错误;
B.纯净的氢气在氯气中能够安静的燃烧生成HCl,所以工业上在HCl合成塔中点燃的氢气通入氯气产生HCl,故B正确;
C.氯气在空气中不燃烧,故C错误;
D.点燃氢气和氯气混合气体会发生爆炸,不适合于工业生产,故D错误.
故选B.
点评 本题考查了工业上制备HCl的原理,题目难度不大,注意理论联系实际,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
6.关于金属的冶炼,下列说法正确的是( )
| A. | 通过电解饱和食盐水可制得单质Na | |
| B. | 工业上常用H2还原MgO制得单质Mg | |
| C. | 通过加热分解HgO可制得单质Hg | |
| D. | 用铝热法还原MnO2和Fe2O3,制得金属各1mol,消耗铝较少的是MnO2 |
7.某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了下列实验:
某温度下,取10g该溶液于烧杯中,滴入溶质质量分数为50%的K2CO3饱和溶液.滴入碳酸钾溶液质量与生成沉淀质量的关系如图所示.下列说法错误的是:( )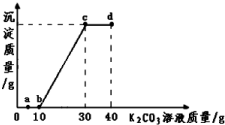
某温度下,取10g该溶液于烧杯中,滴入溶质质量分数为50%的K2CO3饱和溶液.滴入碳酸钾溶液质量与生成沉淀质量的关系如图所示.下列说法错误的是:( )

| A. | 向a点对应的溶液中滴加无色酚酞试液,溶液为无色 | |
| B. | 该温度下,K2CO3的溶解度为100g | |
| C. | 由图象可得,10g该溶液中氯化钙的质量约为8g | |
| D. | b、c、d三点对应的溶液中分别含有两种溶质 |
4.下列物质按只含离子键、只含共价键、既含离子键又含共价键的顺序排列的是( )
| A. | 氯气 二氧化碳 氢氧化钠 | B. | 氯化钠 过氧化钠 氯化铵 | ||
| C. | 氯化钠 过氧化氢 氯化铵 | D. | 氯化钠 氦气 氢氧化钠 |
9. 铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:
铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$;Q>0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.006mol/(L•min);
(3)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2. K2FeO4在处理水的过程中所起的作用有杀菌消毒、净水(吸附悬浮物);
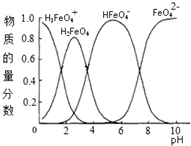
(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如图所示:
(1)pH=2时溶液存在如下等量关系:c(K+)=2c(H2FeO4)+2c(H3FeO4+)+2c(HFeO4-);
(2)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42-+H2O.
 铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:
铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.006mol/(L•min);
(3)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2. K2FeO4在处理水的过程中所起的作用有杀菌消毒、净水(吸附悬浮物);
(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如图所示:
(1)pH=2时溶液存在如下等量关系:c(K+)=2c(H2FeO4)+2c(H3FeO4+)+2c(HFeO4-);
(2)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42-+H2O.
7.11.6gFe3O4加到100mL某浓度的盐酸中,再加入9.8g铁粉,反应停止时,溶液中无固体存在.向溶液中滴加硫氰化钾溶液,未见颜色变化,为了中和过量的盐酸(不考虑盐酸的挥发),且使铁完全转化成Fe(OH)2,共消耗5.0mol•L-1NaOH溶液160mL.则原盐酸的物质的量浓度为( )
| A. | 2 mol•L-1 | B. | 4 mol•L-1 | C. | 6 mol•L-1 | D. | 8 mol•L-1 |
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题: