题目内容
16.原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为24.(1)W基态原子的核外电子排布式为1s22s22p63s23p63d24s2,元素X、Y、Z的第一电离能由大到小的顺序为N>O>C;(用元素符号表达)
(2)与XYZ-互为等电子体的化学式为CO2、SCN-;
(3)1mol H2X2Z4分子中含有σ键的数目为7×6.02×1023;
(4)YH3极易溶于水的主要原因是氨分子与水分子间易形成氢键.
分析 元素X的原子最外层电子数是其内层的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y基态原子的2p轨道上有3个电子,Y的核外电子排布式为1s22s22p3,则Y为N元素;Z是地壳中含量最多的元素,则Z为O元素;W的原子序数为22,则W为Ti,以此解答该题.
解答 解:元素X的原子最外层电子数是其内层的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y基态原子的2p轨道上有3个电子,Y的核外电子排布式为1s22s22p3,则Y为N元素;Z是地壳中含量最多的元素,则Z为O元素;W的原子序数为22,则W为Ti.
(1)W核外电子数为22,基态原子的核外电子排布式为1s22s22p63s23p63d24s2;
同周期随原子序数增大,元素第一电离能呈增大强酸,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C,
故答案为:1s22s22p63s23p63d24s2;N>O>C;
(2)原子总数相等、价电子总数相等微粒互为得电子,与CNO-互为等电子体的一种分子、一种离子分别为CO2、SCN-等,故答案为:CO2、SCN-;
(3)二元弱酸H2C2O4的结构式为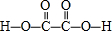 ,分子中C原子形成3个σ键,1mol H2C2O4分子中含有σ键的数目为7×6.02×1023,
,分子中C原子形成3个σ键,1mol H2C2O4分子中含有σ键的数目为7×6.02×1023,
故答案为:7×6.02×1023;
(4)氨分子与水分子间易形成氢键,NH3极易溶于水,故答案为:氨分子与水分子间易形成氢键.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、等电子体、杂化轨道、化学键、氢键等,比较全面的考查物质结构主干知识,需要学生具备扎实的基础,注意同周期中第一电离能异常情况,难度中等.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
1.糖类、油脂、蛋白质是人类重要的营养物质,下列叙述正确的是( )
| A. | CuSO4溶液能使蛋白质变性 | |
| B. | 葡萄糖能发生氧化反应和水解反应 | |
| C. | 淀粉、油脂、蛋白质都是高分子化合物 | |
| D. | 植物油都不能使溴的四氯化碳溶液褪色 |
8.人们常将在同一原子轨道上运动的、自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”.以下有关主族元素原子的“电子对”和“未成对电子”的说法,错误的是( )
| A. | 核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” | |
| B. | 核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子” | |
| C. | 核外电子数为偶数的基态原子,其原子轨道中一定含有“电子对” | |
| D. | 核外电子数为奇数的基态原子,其原子轨道中可能含有“电子对” |
5.某无色溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸,沉淀不溶解,则有关溶液中含有的离子说法正确的是( )
| A. | 一定有SO42- | |
| B. | 一定没有SO42- | |
| C. | 一定有Ag+ | |
| D. | 可能是SO42-,也可能是Ag+,但二者不能同时存在 |
20.下列塑料的合成,所发生的化学反应不同于另外三种的是( )
| A. | 聚乙烯塑料 | B. | 聚氯乙烯塑料 | C. | 聚苯乙烯塑料 | D. | 酚醛树脂塑料 |
 +2nH2O.
+2nH2O.
 图(1、2)是有关氨的制取和性质的实验装置.
图(1、2)是有关氨的制取和性质的实验装置.