题目内容
7.物质A是一种高熔点的化合物,不溶于硫酸、硝酸等强酸.A用纯碱熔融生成化合物B的同时放出无色气体C(标准状态下,密度为1.96g/L).若将C通入B的溶液中得到化合物D,D在空气里干燥转化至化合物E,E经加热又可得到A.(1)化合物A、E的化学式:A:SiO2;E:H2SiO3.
(2)将少量C通入B的溶液发生反应的方程式:CO2+Na2SiO3+2H2O=H4SiO4+Na2CO3
(3)化合物A能溶于什么酸?(填名称):氢氟酸.溶解反应的方程式为:SiO2+4HF=SiF4+2H2O.
分析 物质A是一种高熔点化合物,不溶于硫酸、硝酸等强酸.A与纯碱熔融反应,生成化合物B,同时放出气体C;把气体C通入B的溶液中,则得到化合物D;D在干燥空气中转变为化合物E;将E加热又得到化合物A,可初步判断A可能是SiO2,B可能是Na2SiO3,C可能是CO2.若把CO2通入Na2SiO3溶液中,会得到胶状沉淀H4SiO4,H4SiO4在干燥空气中易脱水生成H2SiO3,H2SiO3加热生成SiO2.带入验证反应过程设定符合.
解答 解:A是不溶于硫酸、硝酸等强酸的高熔点化合物,它能与纯碱熔融反应,而且放出气体C,生成化合物B,可初步判断A可能是SiO2,B可能是Na2SiO3,C可能是CO2.若把CO2通入Na2SiO3溶液中,会得到胶状沉淀H4SiO4,H4SiO4在干燥空气中易脱水生成H2SiO3,H2SiO3加热生成SiO2.带入验证反应过程设定符合;
推断各物质为:A:SiO2,B:Na2SiO3,C:CO2,D:H4SiO4,E:H2SiO3;
(1)化合物A、E的化学式:A:SiO2; E:H2SiO3,故答案为:SiO2;H2SiO3;
(2)将少量CO2通入Na2SiO3的溶液发生反应的方程式:CO2+Na2SiO3+2H2O=H4SiO4+Na2CO3,故答案为:CO2+Na2SiO3+2H2O=H4SiO4+Na2CO3;
(3)二氧化硅溶于氢氟酸;反应的化学方程式为:SiO2+4HF=SiF4+2H2O,故答案为:氢氟酸;SiO2+4HF=SiF4+2H2O.
点评 本题考查了物质转化关系和物质性质的分析应用,转化关系的反应条件和反应特征是推断的突破口,掌握特征反应是解题关键,题目难度中等.

练习册系列答案
相关题目
17.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,断开化学键吸收的能量大于形成化学键所放出的能量 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H=QKJ/mol |
18.H2和CO2在催化剂作用下能缓慢地起反应生成CH3OH和H2O,对此反应,下列叙述中正确的是( )
| A. | 使用催化剂不能改变反应速率 | B. | 降低压强能使反应速率加快 | ||
| C. | 改变压强对反应速率没有影响 | D. | 升高温度能加快反应速率 |
12.下列物质为纯净物的是( )
| A. | C4H10 | |
| B. | 淀粉 | |
| C. | 提纯后的 Fe(OH)3 胶体 | |
| D. | 分子中共用电子对对数为 7 的烷烃 |
19.X、Y、W、Q 四种元素在元素周期表中的位置如图,下列叙述错误的是( )
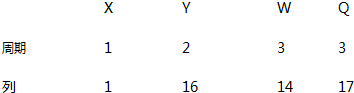
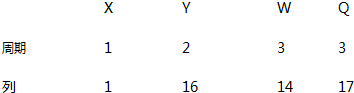
| A. | Y 的氢化物沸点高于 Q 的氢化物沸点 | |
| B. | 最高正价与最低负价之和为 0 的元素只有 W | |
| C. | 原子半径顺序为:r(W)>r(Q)>r(Y)>r(X) | |
| D. | X、Y、Q 三元素形成的分子中,原子最外层电子数之和最大为 32 |

 ;
;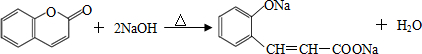 ;
; 或
或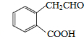 (任写一种);
(任写一种);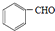 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 .
.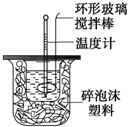 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: