题目内容
5.常温下,向饱和澄清石灰水中加入少量CaO固体,充分反应后恢复到原来的温度,所得溶液中( )| A. | c(Ca2+)、c(OH-)均增 | B. | c(Ca2+)、c(OH-)均保持不变 | ||
| C. | c(Ca2+)、c(OH-)均减小 | D. | 溶液质量增大 |
分析 氧化钙溶于水放出大量的热,充分反应后,恢复到室温,仍让是氢氧化钙的饱和溶液,据此解答即可.
解答 解:温度不变,氢氧化钙溶液的溶度积常数不变,故溶液中钙离子浓度和氢氧根离子的浓度不变,故A、C错误,B正确;由于反应消耗水,导致氢氧化钙析出固体,那么溶液质量减小,故D错误,故选B.
点评 本题主要考查的是饱和溶液的定义以及温度与溶解度的关系,本题的难度不大,属于常考题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )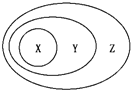

| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 溶液 | 分散系 | 混合物 |
| B | 铜 | 金属元素 | 元素 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A. | A | B. | B | C. | C | D. | D |
16.X、Y、Z在元素周期表中的位置如图所示,已知非金属元素X有多中单质,其中一种常用做电极材料,下列说法中正确的是( )
| X | Y | |
| Z |
| A. | X、Y的最高价氧化物溶于水后的溶液一定显酸性 | |
| B. | 原子半径由大到小的顺序:Z>X>Y | |
| C. | Z的简单离子对水的电离没有影响 | |
| D. | Z的氯化物与氧化物都属于离子化合物 |
13.如下图,利用培养皿探究SO2的性质.实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面.下表中对实验现象的描述或所做的解释不正确的是( )

| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
17.下列粒子在化学反应中既能显示氧化性又能显示还原性的是( )
| A. | Fe3+ | B. | Cl- | C. | Al | D. | H2O2 |
14.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 任何状况下,78克过氧化钠的分子数为NA | |
| B. | 标况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标况下,22.4L水中含水分子为NA | |
| D. | 含NA个Na+的Na2O溶解于水配成1L溶液中,Na+的物质的量浓度为1mol•L-1 |
 (增塑剂)②
(增塑剂)② (合成橡胶原料)③CH3CH2CH2CH2OH(萃取剂)
(合成橡胶原料)③CH3CH2CH2CH2OH(萃取剂) 香料)
香料)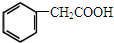 (植物生长刺激素)
(植物生长刺激素)