题目内容
1.为测定常温下下1mol氢气的体积,称取0.110g镁带跟10.0mL稀硫酸(足量)进行实验,抽气调压后,液体量瓶中液体体积为118.0mL.抽出的气体体积为6.0mL,则生成的氢气体积为106mL,测得常温下1mol氢气的体积为114L(精确到0.001),若已知实验温度下1mol氢气体积理论值为24.5L,则该实验结果的误差为1.5%.分析 依据实验步骤分析,加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积
解答 实验步骤分析,加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积;图表数据分析气体体积X=118mL-10mL+6mL=114mL;实验测定体积为114mL,计算得到1mol氢气的体积=$\frac{0.114L×24g/mol}{0.110g}$×1mol=24.873L;实验误差=$\frac{实验值-理论值}{理论值}$×100%=$\frac{24.873-24.5}{24.5}$×100%=1.5%.
故答案为:114;1.5.
点评 本题考查了探究物质的组成或测量物质的含量的实验设计,主要是测定物质氢气体积的方法和步骤,数值换算和数据应用,误差分析判断的依据,注意表格中数据的计算应用,题目难度中等.

练习册系列答案
相关题目
12.4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为15,W的最高价与最低价代数和为0,Y是同周期元素中离子半径最小的,Y、Z原子序数之差为4,下列说法不正确的是( )
| A. | X是短周期元素中原子半径最大的 | |
| B. | X元素最高价氧化物对应的水化物,可以与其他三种元素最高价氧化物对应的水化物反应 | |
| C. | WZ4分子中每个原子最外层均达到8电子结构 | |
| D. | X元素的氧化物中只存在离子键 |
16.X、Y、Z在元素周期表中的位置如图所示,已知非金属元素X有多中单质,其中一种常用做电极材料,下列说法中正确的是( )
| X | Y | |
| Z |
| A. | X、Y的最高价氧化物溶于水后的溶液一定显酸性 | |
| B. | 原子半径由大到小的顺序:Z>X>Y | |
| C. | Z的简单离子对水的电离没有影响 | |
| D. | Z的氯化物与氧化物都属于离子化合物 |
6.下列各组同体积、同物质的量浓度的溶液混合后,所得溶液的pH不大于7的是( )
①CH3COONa、HCl、NaHCO3②Na2S、KNO3、KCl③Ba(NO3)2、NH4Cl、Na2CO3④AgNO3、HCl、CH3COONa⑤K2CO3、HCl、HNO3⑥KCl、Na2S、HCl.
①CH3COONa、HCl、NaHCO3②Na2S、KNO3、KCl③Ba(NO3)2、NH4Cl、Na2CO3④AgNO3、HCl、CH3COONa⑤K2CO3、HCl、HNO3⑥KCl、Na2S、HCl.
| A. | ①③⑤ | B. | ③④⑤ | C. | ①②⑥ | D. | ②④⑥ |
13.如下图,利用培养皿探究SO2的性质.实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面.下表中对实验现象的描述或所做的解释不正确的是( )

| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |

 (增塑剂)②
(增塑剂)② (合成橡胶原料)③CH3CH2CH2CH2OH(萃取剂)
(合成橡胶原料)③CH3CH2CH2CH2OH(萃取剂) 香料)
香料)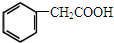 (植物生长刺激素)
(植物生长刺激素)