题目内容
2.下列关于碱金属的说法中,正确的是( )| A. | 碱金属单质的密度都比水小 | |
| B. | 碱金属单质都是还原剂 | |
| C. | 碱金属单质的熔沸点一般随着原子的电子层数的增多而升高 | |
| D. | 碱金属单质在氧气中燃烧,产物都是过氧化物 |
分析 A.碱金属单质中Rb、Cs密度都大于水;
B.碱金属单质在反应中都易失电子;
C.碱金属单质的熔沸点一般随着原子序数电子层数增多而降低;
D.Li在氧气中燃烧生成氧化锂.
解答 解:A.碱金属单质中Rb、Cs密度都大于水,Li、Na、K的密度都小于水,故A错误;
B.碱金属单质在反应中都易失电子,所以在反应中作还原剂,故B正确;
C.金属晶体熔沸点与金属半径成反比,所以碱金属单质的熔沸点一般随着原子序数电子层数增多而降低,故C错误;
D.Li在氧气中燃烧生成氧化锂,钠在氧气中燃烧生成过氧化钠,但K在氧气中燃烧生成超氧化钾,故D错误;
故选B.
点评 本题考查同一主族元素性质递变规律,为高频考点,明确原子结构与元素性质关系是解本题关键,注意碱金属中只有Li燃烧生成氧化物,易错选项是D.

练习册系列答案
相关题目
12.4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为15,W的最高价与最低价代数和为0,Y是同周期元素中离子半径最小的,Y、Z原子序数之差为4,下列说法不正确的是( )
| A. | X是短周期元素中原子半径最大的 | |
| B. | X元素最高价氧化物对应的水化物,可以与其他三种元素最高价氧化物对应的水化物反应 | |
| C. | WZ4分子中每个原子最外层均达到8电子结构 | |
| D. | X元素的氧化物中只存在离子键 |
13.如下图,利用培养皿探究SO2的性质.实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面.下表中对实验现象的描述或所做的解释不正确的是( )

| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
17.下列粒子在化学反应中既能显示氧化性又能显示还原性的是( )
| A. | Fe3+ | B. | Cl- | C. | Al | D. | H2O2 |
7.下列化工生产原理正确的是( )
| A. | 可以电解熔融的氯化钠来制取金属钠 | |
| B. | 可以将钠加入氯化镁饱和溶液中制取镁 | |
| C. | 用电解法冶炼铝时,原料是氯化铝 | |
| D. | 在浓缩的海水加入新制氯水即可得到液溴 |
14.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 任何状况下,78克过氧化钠的分子数为NA | |
| B. | 标况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标况下,22.4L水中含水分子为NA | |
| D. | 含NA个Na+的Na2O溶解于水配成1L溶液中,Na+的物质的量浓度为1mol•L-1 |
 (增塑剂)②
(增塑剂)② (合成橡胶原料)③CH3CH2CH2CH2OH(萃取剂)
(合成橡胶原料)③CH3CH2CH2CH2OH(萃取剂) 香料)
香料)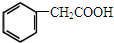 (植物生长刺激素)
(植物生长刺激素)