题目内容
将氯化钡溶液逐滴加入硫酸钠溶液中,溶液的导电能力 (填“变大”“变小”“不变”).
考点:电解质溶液的导电性
专题:电离平衡与溶液的pH专题
分析:溶液的导电能力与离子浓度成正比,离子浓度越大其溶液导电能力越大,将氯化钡溶液逐滴加入硫酸钠溶液中,发生反应Na2SO4+BaCl2=BaSO4↓+2NaCl,硫酸钡是难溶性物质,NaCl为强电解质,根据溶液中离子浓度大小判断溶液导电能力大小.
解答:
解:将氯化钡溶液逐滴加入硫酸钠溶液中,发生反应Na2SO4+BaCl2=BaSO4↓+2NaCl,反应前后溶液中钠离子的物质的量不变,但溶液体积增大,离子浓度减小,所以导电能力减小.
故答案为:变小.
故答案为:变小.
点评:本题考查了溶液导电能力大小的判断,明确物质间的反应、物质的性质、离子浓度大小与溶液导电能力的关系即可解答,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、SO2、SO3都是极性分子 |
| B、凡是中心原子采取sp3杂化轨道成键的分子其空间构型都是正四面体 |
| C、同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物 |
| D、干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
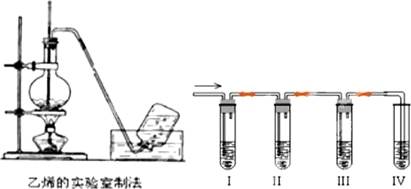
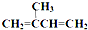 )为主要原料来进行的有机合成:
)为主要原料来进行的有机合成: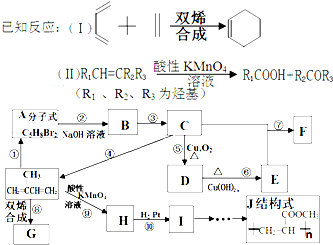
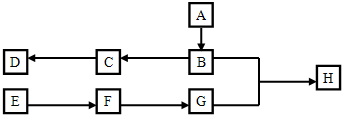
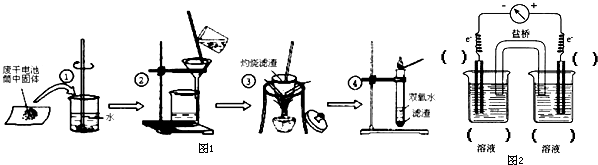
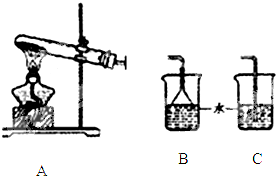 某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2